3.1. GmGT-2F的分子特征与表达分析
家族鉴定: 大豆三螺旋转录因子家族包含71个成员。
归类分型: 系统发育分析将其分为六个亚家族,GmGT-2F属于GT-2亚家族。
基序分析: GT-2亚家族成员含有独特的保守基序Motif 4。
共线性:GmGT-2F与家族内其他成员存在强遗传相关性。
顺式元件: 其启动子区域含有多种响应性顺式作用元件。
表达模式:GmGT-2F在花和种子发育的中后期高表达。
亚细胞定位:GmGT-2F–GFP融合蛋白定位于细胞核。
大豆中的三螺旋转录因子家族共包含71个成员,系统发育分析将其归入六个亚家族,其中GmGT-2F(Glyma.03G246000)属于GT-2亚家族。保守基序分析显示,GT-2亚家族拥有一个可能决定其功能特异性的独特基序(Motif 4)。共线性分析揭示了GmGT-2F与GmGT-2B、GmGT-2R和GmGT-2V等成员间存在紧密的遗传关系,其蛋白序列,特别是在N端和C端的Myb样DNA结合域高度保守。对GmGT-2F启动子区域的分析鉴定出多种与光、激素及胁迫响应相关的顺式作用元件。基因表达分析表明,GmGT-2F在花以及种子发育的中后期阶段表达水平显著升高。亚细胞定位实验证实,GmGT-2F蛋白定位于细胞核内,这与其作为转录因子的功能相符 (Fig. 1)。
图1. GmGT-2F编码一个三螺旋转录因子(A) 大豆(Glycine max)三螺旋家族转录因子的系统发育树,不同组别以颜色区分。树的外围展示了组织特异性表达谱。(B) GmGT-2F及其在拟南芥(Arabidopsis thaliana)和菜豆(Phaseolus vulgaris)中同源蛋白的序列比对。aa,氨基酸。(C) RT-qPCR测定的GmGT-2F在不同大豆组织中的差异表达。Cot,子叶期;DS,干籽;EM,成熟早期;LM,成熟后期;MM,成熟中期。以GmGT-2F在叶片中的表达作为校准。数据表示为平均值±标准误(n = 3)。星号表示与对照相比存在显著差异(学生t检验:** P < 0.01)。(D) GmGT-2F在拟南芥叶肉原生质体中的亚细胞定位,显示了GFP标记的GmGT-2F的表达。比例尺 = 10 μm。
3.2 GmGT-2F提高转基因大豆种子的油含量
创制株系: 构建了GmGT-2F的CRISPR敲除株系和过表达株系。
蛋白调控:GmGT-2F负向调控种子蛋白含量。
油分调控:GmGT-2F正向调控种子油分积累。
脂肪酸组分: 过表达GmGT-2F可提高油酸和亚油酸等不饱和脂肪酸的水平。
超微结构:GmGT-2F调控油体(OB)和蛋白储藏泡(PSV)的数量平衡。
为探究GmGT-2F的功能,利用CRISPR-Cas9技术创制了其敲除突变体(gmgt-2f-cr),并构建了过表达株系(GmGT-2F-OE)。表型分析显示,与野生型(WT)相比,GmGT-2F-OE株系的种子蛋白含量显著降低,而gmgt-2f-cr株系的蛋白含量则显著升高,表明GmGT-2F对种子蛋白含量起负向调控作用。相反地,油含量分析结果显示,GmGT-2F-OE株系的油含量显著增加了4.71%–7.37%,而gmgt-2f-cr株系则显著降低了8.76%–11.11%,证实GmGT-2F是种子油分积累的主要正向调控因子。进一步的脂肪酸组分分析发现,GmGT-2F过表达能显著提高油酸(C18:1)和亚油酸(C18:2)的含量。透射电镜观察揭示,在成熟种子中,GmGT-2F-OE株系的油体(OBs)数量显著增多,而蛋白储藏泡(PSVs)数量减少;gmgt-2f-cr株系则呈现相反的表型。这些结果共同证实,GmGT-2F作为油含量的正调控因子和蛋白含量的负调控因子,调控着种子中两者的平衡 (Fig. 2)。
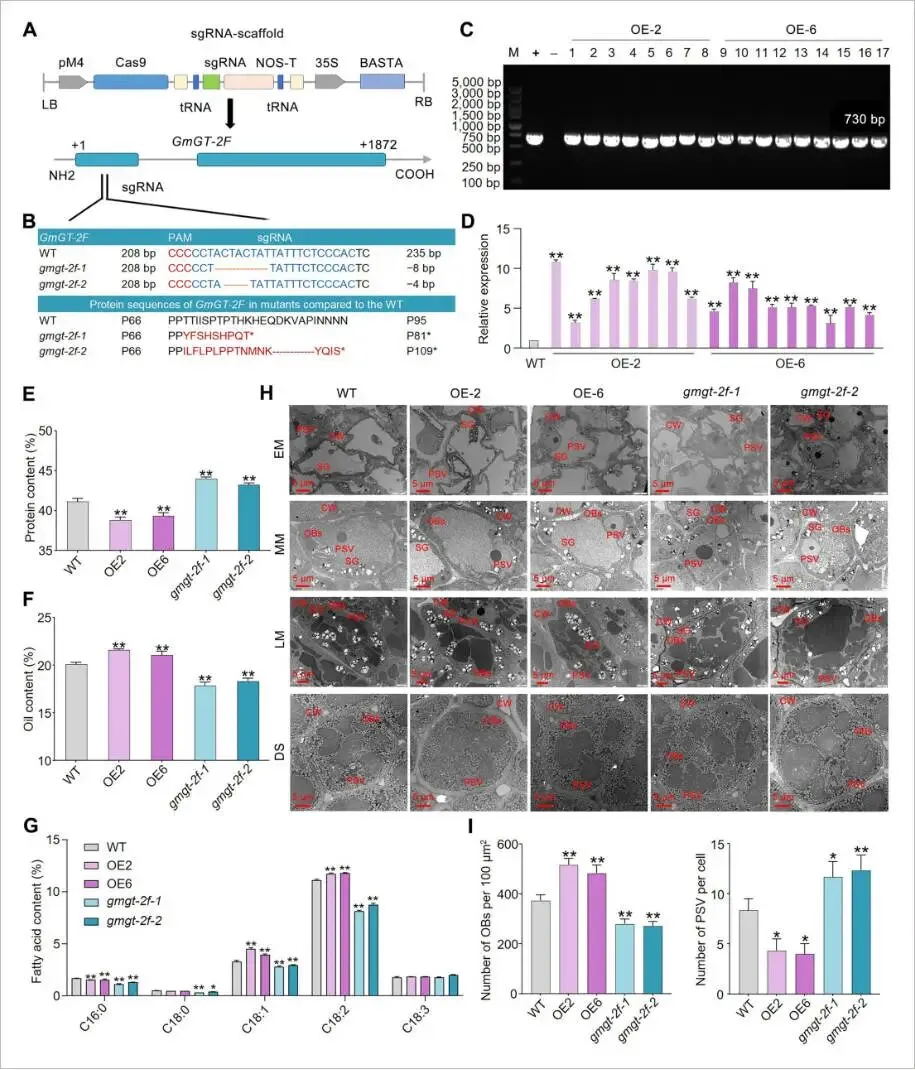
图2. gmgt-2f敲除和GmGT-2F-OE大豆株系的种子油和蛋白含量分析(A) CRISPR/Cas9构建示意图及GmGT-2F内的靶位点。(B) 在gmgt-2f-1和gmgt-2f-2敲除株系中观察到的突变类型和氨基酸变化。(C) 过表达GmGT-2F的T₃代转基因植株的聚合酶链式反应(PCR)验证。泳道1–8:OE-2株系;泳道9–17:OE-6株系;M:DNA分子量标准;+:阳性质粒对照;−:阴性对照(DN50)。(D) RT-qPCR确认T₃代过表达株系中GmGT-2F的表达。数据表示为平均值±标准误(n = 3)。(E–G) WT、GmGT-2F-OE和gmgt-2f-cr株系成熟种子中总蛋白含量(E)、总油含量(F)和脂肪酸组分(G)的定量分析。数据表示为平均值±标准误(n = 4)。(H) 利用扫描透射电子显微镜对WT、GmGT-2F-OE和gmgt-2f-cr株系子叶细胞的超微结构观察。阶段:EM(成熟早期),MM(成熟中期),LM(成熟后期),DS(干籽);CW:细胞壁;OB:油体;PSV:蛋白储藏泡;SG:淀粉粒。比例尺 = 5 μm。(I) 对每组六个子叶切片中每100 μm²的OB数量和PSV面积的定量。数据表示为平均值±标准误(n = 6)。星号表示与WT相比的显著差异(学生t检验:* P < 0.05, ** P < 0.01)。
3.3 GmGT-2F调控种子大小和重量
农艺性状:GmGT-2F不影响株高和荚数。
种子大小: 负向调控种子长宽。
种子重量: 负向调控百粒重和单株粒重。
对成熟期植株的农艺性状评估发现,GmGT-2F的表达水平对株高或单株荚数没有显著影响。然而,GmGT-2F-OE株系的种子长、宽均显著小于野生型,而gmgt-2f-cr株系的种子尺寸则显著增大。与此趋势一致,GmGT-2F-OE株系的百粒重和单株粒重均显著下降,而gmgt-2f-cr株系则显著增加。这些结果表明GmGT-2F对大豆的种子大小和重量具有负向调控作用 (Fig. 3A-C)。
图3. 野生型(WT)、GmGT-2F-OE和gmgt-2f株系的产量性状分析及OE-6与WT成熟种子的转录组分析(A) WT、GmGT-2F-OE和gmgt-2f株系整株植物的表型比较。比例尺 = 10 cm。(B) 多个发育阶段的豆荚和种子形态。比例尺 = 1 cm。(C) WT和转基因株系中株高、单株荚数、种子长度、种子宽度和百粒重的定量。数据表示为平均值±标准误(n = 8)。星号表示与WT相比的显著差异(学生t检验:* P < 0.05, ** P < 0.01)。(D) 比较OE-6和WT成熟种子的RNA-seq数据的主成分分析(PCA)。(E) 展示OE-6和WT样本间差异表达基因(DEGs)的火山图。(F) OE-6和WT植株间DEGs的KEGG通路富集分析。
3.4 GmGT-2F下游靶基因的鉴定
转录组分析: 鉴定出1194个差异表达基因(DEGs)。
通路富集: DEGs富集于蛋白加工和脂肪酸代谢等通路。
DAP-seq分析: 鉴定出3337个GmGT-2F的潜在结合基因。
联合筛选: 筛选到21个高可信度的直接靶基因。
靶点确证: 锁定GmAGAL为关键下游靶基因。
为了鉴定受GmGT-2F调控的基因,对GmGT-2F过表达株系OE-6和野生型的成熟种子进行了RNA-seq分析。共鉴定出259个显著上调和935个显著下调的基因。KEGG富集分析显示,这些差异表达基因(DEGs)主要与内质网蛋白加工、糖酵解/糖异生、脂肪酸生物合成与降解等代谢通路相关,表明它们与种子油和蛋白的生物合成密切相关。为进一步寻找GmGT-2F的直接结合靶点,进行了DAP-seq分析,共鉴定出3337个基因上的32,549个结合峰,其中10.84%位于启动子区域。通过将RNA-seq上调的基因与DAP-seq的结合靶基因进行整合分析,最终筛选出21个高可信度的GmGT-2F下游靶基因。其中,编码α-半乳糖苷酶的基因Glyma.10G174500(命名为GmAGAL)被证实参与甘油脂和半乳糖代谢,被确定为一个关键的候选下游靶基因 (Fig. 3D-F, 4A-C)。
图4. GmGT-2F直接结合GmAGAL启动子并激活其转录(A) DAP-seq鉴定的GmGT-2F结合峰在基因组特征上的分布。(B) 显示以转录起始位点(TSS)和转录区域为中心的GmGT-2F结合峰分布的元图。(C) 展示RNA-seq上调的差异表达基因(DEGs)与DAP-seq鉴定基因之间重叠的维恩图。(D) 酵母单杂交(Y1H)实验证实GmGT-2F与GmAGAL启动子的结合。转化子在补充有3-AT的TDO培养基上进行筛选。pGADT7空载体作为阴性对照。DDO: SD/–Leu/–Trp; TDO: SD/–Leu/–Trp/–His。(E) 双荧光素酶报告实验中所用构建体的示意图。(F) 在本氏烟草叶片中显示GmGT-2F对GmAGAL启动子转录激活作用的双荧光素酶报告实验。数据表示为平均值±标准误(n = 4)。星号表示显著差异(学生t检验:** P < 0.01)。(G) 用于电泳迁移率变动分析(EMSA)的GmAGAL启动子区域示意图。预测的GmGT-2F结合位点(M1和M2)已标出。富集的结合基序的DNA logos使用HOMER生成。(H) EMSA证实重组GmGT-2F与生物素标记的GmAGAL启动子探针的直接结合。结合特异性通过使用未标记的竞争探针和缺少GmGT-2F结合基序的突变探针进行验证。
3.5 GmGT-2F直接激活GmAGAL的转录
Y1H验证: 证实GmGT-2F与GmAGAL启动子结合。
双荧光素酶: 证明GmGT-2F激活GmAGAL启动子。
EMSA验证: 鉴定出两个特异的DNA结合基序(M1和M2)。
基序突变: 突变M1和M2基序后,激活作用消失。
为验证GmGT-2F与GmAGAL启动子的直接互作,进行了一系列分子实验。酵母单杂交(Y1H)结果显示,共表达pGADT7-GmGT-2F和pHIS2-GmAGALpro的酵母能在筛选培养基上正常生长,表明两者存在特异性结合。双荧光素酶报告实验进一步证实,当GmGT-2F与含有GmAGAL启动子的报告基因共表达时,荧光素酶活性显著增强,证明GmGT-2F能有效激活GmAGAL的转录。通过DAP-seq分析,在GmAGAL启动子上鉴定出两个推定的GmGT-2F结合基序,分别命名为M1(GAGAAGAC)和M2(AAGAAAAAAG)。电泳迁移率变动分析(EMSA)显示,纯化的GmGT-2F蛋白能与含有M1和M2基序的探针结合,且该结合可被未标记的竞争探针所抑制,而突变探针则无法结合。进一步在体内通过基序突变实验验证,当M1和M2序列被突变后,GmGT-2F无法再激活GmAGAL启动子。这些结果共同证明,GmAGAL是GmGT-2F的直接转录靶标,GmGT-2F通过结合其启动子上的M1和M2顺式元件来介导这一调控作用 (Fig. 4D-H, S7)。
3.6 GmGT-2F通过调控α-半乳糖苷酶活性促进油分积累
基因表达:GmAGAL在种子发育后期高表达,受GmGT-2F正调控。
蛋白定位:GmAGAL蛋白定位于线粒体。
酶活调控:GmGT-2F正向调控α-半乳糖苷酶活性。
敲除表型: 敲除GmAGAL或双敲除GmGT-2F/GmAGAL均导致油含量降低。
遗传关系:GmAGAL在GmGT-2F调控油分积累的通路中起下游作用。
对GmAGAL的表达模式分析发现,其在种子发育过程中表达量逐渐增加,并在干籽(DS)阶段达到峰值,表明其在种子成熟中的关键作用。亚细胞定位显示GmAGAL蛋白定位于线粒体。在GmGT-2F-OE株系中,GmAGAL的表达显著上调,而在gmgt-2f-cr株系中则显著下调,这与α-半乳糖苷酶的活性变化趋势一致,证实GmGT-2F正向调控GmAGAL的表达及功能。为了探究GmAGAL在油分合成中的作用,构建了gmagal单突变体和gmgt-2f/gmagal双突变体。表型分析显示,与野生型相比,gmagal和gmgt-2f/gmagal突变体的种子油含量、脂肪酸组分以及油体数量均显著降低。此外,单突变体和双突变体的α-半乳糖苷酶活性均显著低于野生型,且两者之间无显著差异。这些结果表明,GmAGAL是维持正常油含量的必需基因,且其功能位于GmGT-2F的下游。GmGT-2F正是通过增强GmAGAL依赖的α-半乳糖苷酶活性来促进大豆种子中的油分积累 (Fig. 5)。
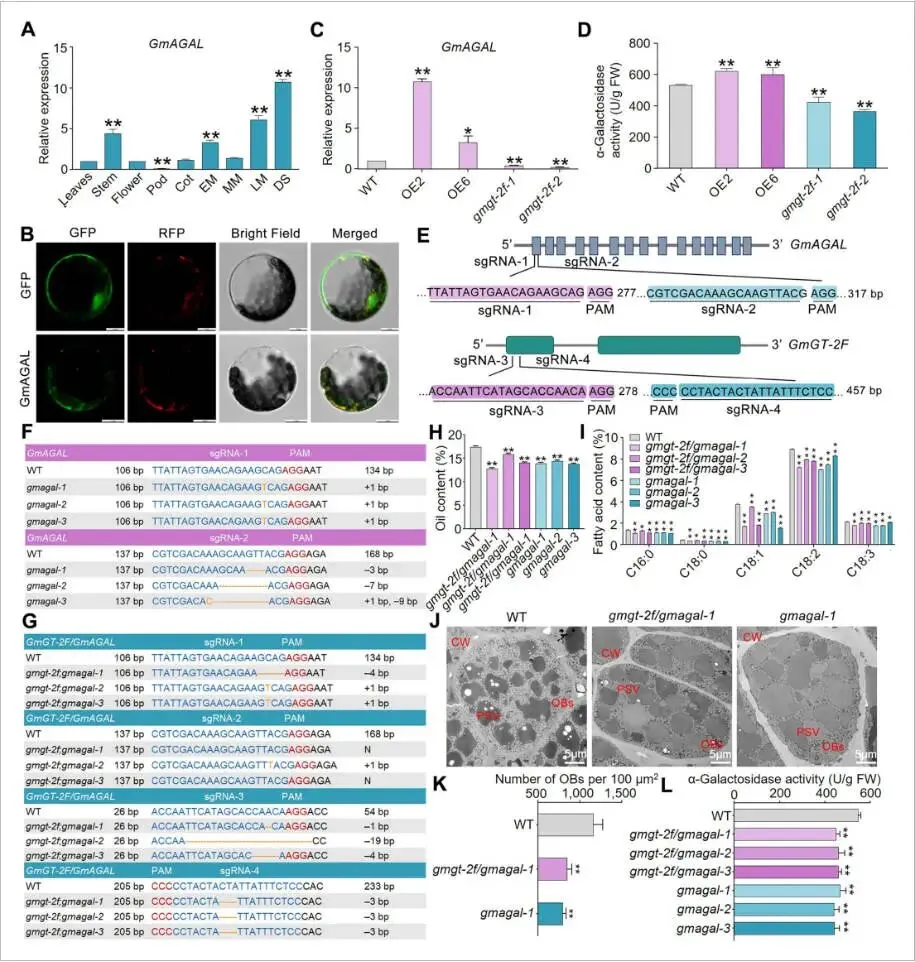
图5. 敲除GmAGAL和GmGT-2F/GmAGAL降低转基因大豆的种子油含量(A) GmAGAL在不同大豆组织中的表达谱。数据表示为平均值±标准误(n = 3)。(B) GmAGAL在拟南芥叶肉原生质体中的亚细胞定位。图像显示GFP荧光(绿色)、线粒体(红色)、明场和合并通道。比例尺 = 10 μm。(C) 通过RT-qPCR测定的野生型(WT)、GmGT-2F-OE和gmgt-2f-cr株系DS阶段种子中GmAGAL的表达水平,n = 3。(D) WT、GmGT-2F-OE和gmgt-2f-cr株系DS阶段种子中的α-半乳糖苷酶活性,n = 3。(E) 显示GmAGAL和GmGT-2F的蛋白结构和CRISPR/Cas9靶位点的图示。(F, G) (F) gmagal和(G) gmgt-2f/gmagal突变体的基因编辑结果。插入和缺失分别用橙色字母和短划线表示。右侧注释详细说明了与WT相比的序列变化。(H) WT、gmagal和gmgt-2f/gmagal株系成熟种子的油含量和(I)脂肪酸谱。数据表示为平均值±标准误(n = 4)。(J) WT、gmagal和gmgt-2f/gmagal株系子叶细胞的透射电子显微镜图。CW,细胞壁;OB,油体;PSV,蛋白储藏泡。比例尺 = 5 μm。(K) 基于六个子叶切片对每100 μm²的OB数量的定量。数据表示为平均值±标准误(n = 6)。(L) WT、gmagal和gmgt-2f/gmagal株系中的α-半乳糖苷酶活性。数据表示为平均值±标准误(n = 3)。星号表示与WT相比的显著差异(学生t检验:* P < 0.05, ** P < 0.01)。
3.6 GmCYP2可与GmGT-2F互作
互作筛选: Y2H筛选发现GmCYP2是GmGT-2F的互作蛋白。
互作验证: Y2H、BiFC、LCI、Pull-down和Co-IP实验证实两者在体内外均存在互作。
蛋白共定位: 两者均定位于细胞核,且在种子发育期共表达。
功能抑制:GmCYP2抑制GmGT-2F对GmAGAL启动子的转录激活活性。
为进一步表征GmGT-2F,通过酵母双杂交(Y2H)文库筛选鉴定其互作蛋白,发现了GmCYP2(Glyma.12G024700)。随后通过靶向Y2H、双分子荧光互补(BiFC)、荧光素酶互补成像(LCI)、GST pull-down和免疫共沉淀(Co-IP)等一系列体内外实验,均证实了GmGT-2F与GmCYP2之间存在物理互作。AlphaFold3的蛋白对接预测也支持了这一强相互作用。表达分析显示,GmCYP2与GmGT-2F同样在种子发育过程中高表达,且其蛋白也定位于细胞核,为两者在体内发生互作提供了时空基础。为了探究该互作的功能相关性,进行了双荧光素酶报告实验。结果显示,与单独表达GmGT-2F相比,共表达GmGT-2F和GmCYP2会显著降低GmAGAL启动子的活性。这些发现表明,GmCYP2通过与GmGT-2F物理互作,抑制其对下游靶基因的转录激活能力 (Fig. 6)。
图6. GmGT-2F与GmCYP2发生物理互作(A) 酵母双杂交(Y2H)实验证明GmGT-2F与GmCYP2在酵母细胞中互作。(B) 使用AlphaFold3模型预测的GmGT-2F与GmCYP2的互作。(C) 双分子荧光互补(BiFC)实验证实在本氏烟草表皮细胞中GmGT-2F与GmCYP2的互作。GmGT-2F和GmCYP2分别克隆到nYFP和cYFP融合载体中。比例尺 = 20 μm。(D) 荧光素酶互补成像(LCI)实验显示GmGT-2F与GmCYP2的互作。GmGT-2F-nLUC和cLUC–GmCYP2构建体在本氏烟草叶片中共表达。比例尺 = 1 cm。(E) Pull-down实验证实GmGT-2F-His与GmCYP2–GST之间的互作。使用抗GST和抗His抗体检测免疫沉淀的蛋白。(F) Co-IP实验显示GmGT-2F与GmCYP2在本氏烟草叶片中的互作。输入和沉淀的蛋白通过抗GFP或抗MYC抗体进行免疫印迹分析。(G) 烟草叶片中的瞬时表达实验,显示共表达GmCYP2对GmGT-2F介导的GmAGAL启动子激活的影响。(H) (G)中实验的定量发光分析,n = 4。小写字母表示显著差异(单因素方差分析(ANOVA)检验)。
3.7 GmGT-2F、GmCYP2和GmAGAL的自然变异
GmGT-2F单倍型: 鉴定出3种单倍型,与油、蛋白含量相关。
GmCYP2单倍型: 鉴定出3种单倍型,与油、蛋白含量相关。
GmAGAL单倍型: 鉴定出3种单倍型,与油、蛋白含量相关。
单倍型组合: 特定单倍型组合与极高的油或蛋白含量显著关联。
为了探索这些基因在育种中的应用潜力,对547份大豆种质资源中GmGT-2F、GmCYP2和GmAGAL的自然变异进行了单倍型分析。对于GmGT-2F,共鉴定出三种主要单倍型,其中Hap1和Hap2与较高的油含量相关,而Hap3与较高的蛋白含量相关。功能分析表明,这种功能分化可能源于编码区一个导致脯氨酸到组氨酸替换的非同义突变(S11)。对于互作基因GmCYP2,其Hap2和Hap3与高油含量相关,Hap1与高蛋白含量相关。对于下游基因GmAGAL,其Hap3与高油含量相关,Hap2与高蛋白含量相关。进一步对这些单倍型的组合效应进行分析发现,特定的组合表现出显著的表型效应。例如,GmGT-2F Hap2 / GmCYP2 Hap2 / GmAGAL Hap3的组合达到了最高的油含量(21.72%),而GmGT-2F Hap3 / GmCYP2 Hap1 / GmAGAL Hap1的组合则表现出最高的蛋白含量(47.67%)。这些发现揭示了具有显著表型影响的特定单倍型组合,为高品质大豆的分子育种提供了重要的靶点 (Fig. 7)。
图7. 大豆中GmGT-2F、GmCYP2和GmAGAL的等位基因多样性(A) GmGT-2F、(B) GmCYP2和(C) GmAGAL的等位基因变异。图中显示了单核苷酸多态性(SNPs)和插入/缺失(InDels)的类型和数量,以及表现出每种变异的栽培品种数量(No. of cvs.)。小写字母表示显著差异(单因素方差分析(ANOVA)检验)。
发现新的关键调控因子: 首次鉴定并系统阐明了大豆三螺旋转录因子家族成员GmGT-2F是调控种子油分和蛋白含量的关键因子,填补了该转录因子家族在此功能领域的研究空白。
揭示双重拮抗调控机制: 明确了GmGT-2F对大豆种子关键品质性状的双重拮抗作用,即它作为油分积累和不饱和脂肪酸含量的正向调控因子,同时又是蛋白含量、种子大小和重量的负向调控因子,为解析大豆油分-蛋白平衡的分子机制提供了新的视角。
解析全新的分子调控通路: 完整地解析了一条新的分子调控通路“GmGT-2F–GmAGAL”。研究证实,GmGT-2F通过直接结合其下游靶基因GmAGAL启动子上的两个特异顺式作用元件(M1 和 M2),激活其转录,进而调控α-半乳糖苷酶的活性来影响油分积累。
发现新的蛋白互作与负调控模块: 发现了一个全新的蛋白互作与功能抑制模块,即亲环素蛋白GmCYP2能够与GmGT-2F发生直接的物理互作,并抑制GmGT-2F对其下游靶基因GmAGAL的转录激活能力,为该调控网络增加了新的精密调控层次。
关联转录调控与代谢功能: 建立了从基因转录调控到具体代谢功能的直接联系,阐明了GmGT-2F通过调控GmAGAL的表达和α-半乳糖苷酶活性,进而影响种子中的蔗糖分布,最终调控碳源在油分和蛋白合成之间的分配。
提供育种应用的优异基因资源: 首次对该调控通路中的三个关键基因(GmGT-2F、GmCYP2、GmAGAL)在覆盖广泛遗传背景的自然群体中进行了单倍型分析,并鉴定出与高油或高蛋白性状显著关联的优异单倍型及其组合,为大豆高品质性状的分子设计育种提供了极具价值的基因资源和直接可用的育种靶点。