碳青霉烯耐药肺炎克雷伯菌(CRKP)已成为院内感染的主要病原体,导致高发病率和死亡率,对公共卫生构成重大威胁。当CRKP菌株获得高毒力质粒,或碳青霉烯酶编码质粒转移到高毒力菌株中时,会产生碳青霉烯耐药高毒力肺炎克雷伯菌(CR-HvKP),对人类和动物健康构成更大威胁。CR-HvKP最初在亚太地区发现,现已在全球范围内频繁报道,包括欧洲、南美、非洲和北美。在医疗机构中,CR-HvKP导致更高的死亡率,表明其在临床环境中快速传播并引发致命暴发的潜力,加剧了人们对CR-HvKP可能成为下一个多重耐药"超级细菌"病原体的担忧。
对CR-HvKP而言,肠道定植通常是后续侵袭性感染的第一步。肠道正常菌群可以保护宿主免受CR-HvKP定植,这种现象被称为"定植抗性"。从住院患者肠道中清除CR-HvKP可以预防感染,然而基于抗生素的清除方法与耐药性发展和其他耐药革兰氏阴性菌的选择相关。近年来,清除策略越来越关注调节肠道微生物群。例如,粪菌移植(FMT)已成功用于消除感染个体中的碳青霉烯耐药肠杆菌科(CRE)定植。此外,应用工程化微生物群落在控制生态位方面显示出疗效,从而恢复定植抗性。特定克雷伯菌治疗已显示通过葡萄糖酸盐竞争对抗CRE感染的前景。
流行病学证据表明CR-HvKP在环境中广泛存在,已在多个宿主中检测到,包括住院患者、零售蔬菜和伴侣动物。然而,监测数据显示猪群中检出率明显较低,提示可能存在物种特异性定植障碍或生态建立屏障。鉴于微生物对宿主生理和免疫系统的显著影响,肠道微生物群可能在促进猪清除能力方面发挥关键作用。然而,不同年龄段猪肠道微生物群的特征及其对CR-HvKP清除的影响仍知之甚少。
近期, 华南农业大学孙坚等在Microbiome期刊上发表了题为Carbohydrate competition by Enterobacteriaceae enhances colonization resistance to carbapenem-resistant hypervirulent K. pneumoniae的研究论文,该研究系统阐明了妊娠母猪肠道微生物对CR-HvKP的定植抗性机制,发现肠杆菌科特别是ST290型肺炎克雷伯菌通过碳水化合物竞争发挥关键保护作用。这一发现为开发基于微生物组的预防和治疗策略提供了重要理论依据。
1) 菌群定植抗性评估:研究团队开发了Micolo定植评估模型,通过构建IS26转座子-luxCDABE系统标记CR-HvKP菌株VH1-2,实现实时监测。对来自哺乳仔猪、保育猪、育肥猪和妊娠母猪四个生长阶段的猪粪便样本进行分析,发现妊娠母猪肠道菌群对CR-HvKP表现出最强的定植抗性。热灭活实验证实这种抗性依赖于活菌,而非代谢产物。
2) 微生物组成分析:16S rRNA基因测序显示,妊娠母猪肠道菌群在家族水平上表现出独特的组成特征,乳杆菌科显著减少,而梭菌科和肠杆菌科显著富集。LEfSe分析进一步确认这些变化与抗CR-HvKP定植能力相关。梭菌科在妊娠母猪和育肥猪之间无显著差异,提示肠杆菌科可能在定植抗性中发挥主要作用。
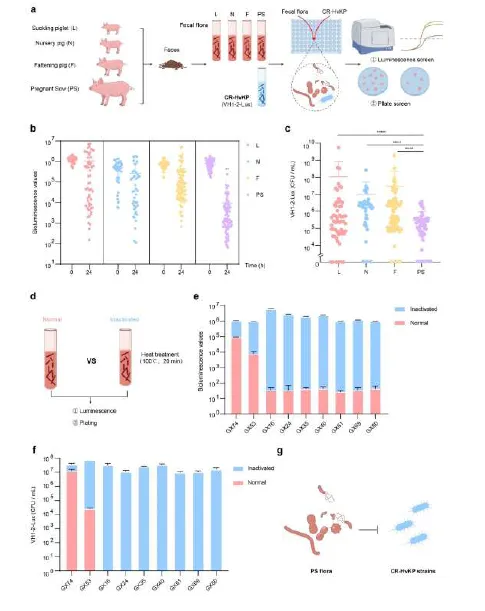
图1 妊娠母猪来源的肠道菌群对碳青霉烯耐药高毒力肺炎克雷伯菌(CR-HvKP)具有强效定植抗性
3) 肠杆菌科的保护作用:从妊娠母猪中分离出13株肠杆菌科细菌,与E. coli Nissle 1917一起进行体外竞争实验。在Mipro培养基和LB培养基中,多株肠杆菌科菌株使CR-HvKP菌量显著降低超过10倍。其中,GX2-22菌株对多种CR-HvKP和CRKP菌株均表现出广谱清除效果,与E. coli Nissle 1917效果相当。
4) 体内验证实验:在链霉素预处理的小鼠模型中,清除肠杆菌科后CR-HvKP定植显著增加。补充GX2-22或E. coli Nissle 1917后,CR-HvKP肠道定植显著减少。微生物组分析显示,GX2-22处理组中乳杆菌属、拟杆菌属等有益菌属相对丰度增加,可能协同抑制CR-HvKP定植。
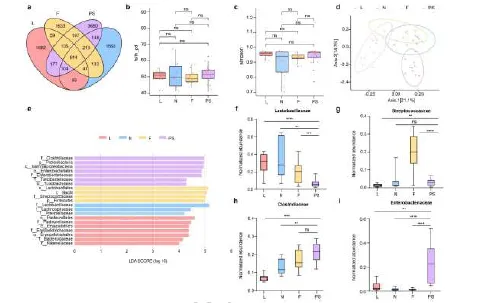
图2 妊娠母猪的肠道菌群中梭菌科与肠杆菌科细菌呈显著富集特征
5) 竞争机制研究:无细胞上清液实验排除了抑菌物质分泌的可能性。全基因组测序和碳水化合物活性酶(CAZyme)分析显示,保护菌株含有独特的糖苷水解酶73(GH73)和糖基转移酶26(GT26)编码基因。单一碳源竞争实验证实,GX2-22通过优先利用碳水化合物(特别是蔗糖)抑制CR-HvKP生长,蔗糖利用率显著高于VH1-2-Lux。补充VH1-2-Lux特异性碳源丙酮酸甲酯可部分恢复其生长,证实碳水化合物竞争是主要抗性机制。
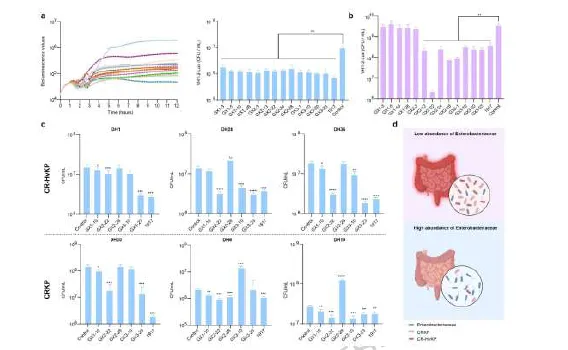
图3 肠杆菌科菌株在体外可介导对多种碳青霉烯耐药高毒力肺炎克雷伯菌(CR-HvKP)及碳青霉烯耐药肺炎克雷伯菌(CRKP)菌株的定植抗性