2026年1月28日,国际顶级学术期刊《自然》(Nature)在线发表中国科研团队重磅研究成果。东北农业大学生命科学学院姜巨全教授课题组联合中国科学院物理研究所、北京大学等单位,首次成功解析人体胆汁酸转运核心蛋白OSTα-OSTβ的高分辨率结构,并阐明其独特工作机制,破解了该领域困扰全球科研界数十年的科学谜题。这也是东北农业大学首次以通讯作者单位在《自然》正刊上发表论文,实现了学校科研发展的历史突破。

据悉,东农生命科学学院2025届博士毕业生王柯、北京大学范俊萍副研究员、东农生命科学学院2023届博士毕业生陈慧文、北京望石智慧科技有限公司黄博、北京大学现代农业研究院迟程教授为论文共同第一作者;姜巨全教授与中国科学院物理研究所姜道华研究员、北京大学化学与分子工程学院雷晓光教授、范俊萍副研究员为共同通讯作者。

原创技术攻坚,解锁蛋白精细结构
胆汁酸是人体消化脂肪的关键物质,其95%的高效利用率依赖于“肝肠循环”,而肠道细胞上的OSTα/β蛋白则是这一循环的核心“总阀门”,直接影响脂肪消化、代谢调节与免疫平衡。该蛋白功能失常会引发胆汁淤积、肝损伤、先天性胆汁酸腹泻等多种疾病。但长期以来,其组装方式与转运机制始终是未解之谜,成为相关药物研发的重要瓶颈。
为破解这一难题,研究团队摒弃传统依赖类似蛋白作为“模板”的研究,采用“原创解析”策略,借助冷冻电镜技术成功破解了OSTα/β的精细三维结构。研究发现,该蛋白为新颖的“异源四聚体”结构,由两个α亚基和两个β亚基组成;同时精准定位了其转运胆汁酸的特殊“口袋”,该“口袋”一半嵌入蛋白内部、一半暴露于细胞膜脂质环境,内部的正电性和亲脂性环境使其能高效“抓取”并转运胆汁酸这类两亲性分子。结合分子动力学模拟,团队还首次捕捉到胆汁酸在转运中完成180度“翻转”的动态过程。
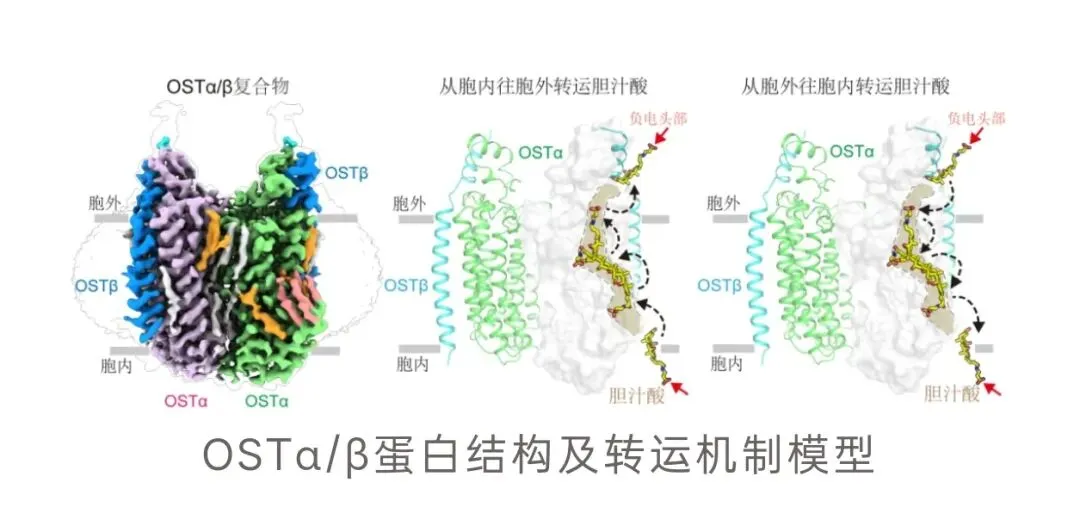
提出颠覆性新转动机制,成果价值深远
基于结构解析结果,研究团队提出了颠覆性的转运新机制,打破了传统溶质转运蛋白的认知。研究证实,OSTα/β无需发生大幅度开合构象变化,而是通过半嵌入膜内的特殊通道,以“摆渡”方式依赖浓度梯度实现胆汁酸的双向运输。这一机制与大多数已知溶质转运蛋白存在显著差异。
该研究成果具有极高的科学价值和广阔的应用前景。在精准诊断方面,揭示了多种已知致病突变是如何破坏蛋白结构或堵塞转运通道的,为相关遗传性疾病的精准分子诊断提供了依据;在药物设计方面,首次呈现的底物结合口袋为靶向药物研发提供精准“锁孔”,为原发性胆汁性胆管炎、非酒精性脂肪性肝病等胆汁酸稳态失衡相关疾病的治疗奠定理论基础;在菌群调控方面,搭建起“胆汁酸代谢”与“肠道微生态”的关联桥梁,为通过干预OSTα/β功能调节肠道菌群、治疗代谢性疾病开辟全新思路。
重大科研突破,彰显学科与育人实力
该研究得到了国家重点研发计划、国家自然科学基金创新研究群体项目、联合基金重点项目及中国科学院相关项目的资助。
通讯作者姜巨全教授是东北农业大学生命科学学院二级教授、博士生导师,深耕膜蛋白结构与功能、盐碱地生态修复、靶向药物研发等领域,科研成果丰硕;入选首届“神农英才”计划神农青年英才、首届青年龙江学者特聘教授,是Nature Communications等十余个期刊审稿专家,中国微生物学会农业微生物专业委员会委员,中国土壤生物与生化专业委员会委员、黑龙江省微生物学会常务理事。共同第一作者王柯、陈慧文均为东北农业大学培养的优秀博士毕业生,已在国际顶级期刊发表多篇高质量研究论文,展现了学校扎实的人才培养功底。
此次研究是东北农业大学在“十五五”开局之年取得的重大科研突破。该成果是学校推进特色高水平研究型大学建设,强化基础学科地位、发挥生物学支撑学科作用的重要体现。
徐小添 哈尔滨日报记者 张巍
家长可扫描下方二维码加入“哈报家长群”