南京农业大学副院长团队发表《Nature》子刊、在权威期刊(IF=16.8)再获进展,揭示大豆疫霉逃避植物免疫的新机制
- 2026-02-02 14:43:38
近日,南京农业大学董莎萌教授与上海交通大学农业与生物学院侯英楠副教授团队在国际权威期刊《Nucleic Acids Research》(五年影响因子16.8)在线发表了关于植物病原菌免疫逃逸机制的重要研究成果,题为Effector gene silencing coordinated by histone methylation and small RNAs enhances host adaptation in a plant pathogen的论文。该研究聚焦于大豆疫霉(Phytophthora sojae)——一种在全球大豆主产区广泛引发根腐病的卵菌病原体,揭示了其通过组蛋白修饰H3K27me3与小RNA(sRNA)协同作用,沉默关键无毒基因(Avr),从而有效逃避寄主免疫识别的新机制,并据此提出了“双重表观遗传沉默机制”的理论模型。上周,董莎萌教授团队还在《Nature Plants》发表了一项题为“Host Microenvironment in Potato–Phytophthora infestans Interaction Revealed by Single-cell Spatiotemporal Transcriptome”的相关研究成果,点击阅读:
南京农业大学副院长团队、入选国家级人才计划,发表《Nature》论文、在《Nature》子刊再获进展,百年难题新突破,揭示马铃薯抗病新机制


植物与病原菌之间的博弈长期遵循经典的“基因对基因”假说:宿主植物依靠特定的抗病(R)蛋白识别病原菌分泌的无毒(Avr)效应蛋白,一旦识别成功,便会迅速激活效应子诱导的免疫反应(ETI),有效遏制病原侵染。然而,病原菌并非被动应对,而是演化出多种策略来规避这种识别,包括无毒基因的序列突变、缺失或表达沉默,从而重新获得致病能力。其中,表达沉默作为一种可逆且不改变DNA序列的调控方式,在病原适应性演化中扮演着关键角色。
大豆疫霉能够分泌一系列含有RxLR基序的效应蛋白以促进侵染,目前已鉴定出九个此类效应蛋白可作为无毒因子,被特定的大豆Rps抗病蛋白识别并触发ETI。本研究以天然沉默Avr1b和Avr3a无毒基因的大豆疫霉ACR10菌株为切入点,借助CRISPR/Cas9技术敲除病原菌多梳抑制复合物2(PRC2)的关键亚基PsSu(z)12,并整合ChIP-seq、RNA-seq和sRNA-seq等多组学分析手段,系统解析了沉默机制的分子基础。结果表明,H3K27me3修饰的缺失不仅导致Avr1b和Avr3a等效应基因的转录重新激活,还伴随着这些位点sRNA水平的显著下降,提示组蛋白修饰与sRNA通路之间存在紧密的功能联系。更进一步地,在PsSu(z)12突变体中引入体外合成的内源双链sRNA,能够有效抑制无毒基因的表达,直接证实了sRNA在效应子沉默中的核心作用。
值得注意的是,这种H3K27me3与sRNA的协同沉默效应具有明显的位点特异性。全基因组分析显示,大多数受H3K27me3调控的RxLR效应基因位点同样富集sRNA信号,说明这一双重调控机制在病原菌中具有广泛适用性。此外,对田间分离的大豆疫霉菌株进行比较分析发现,不同菌株在RxLR效应基因位点上的H3K27me3修饰和sRNA分布呈现出显著异质性,反映出病原群体在自然选择压力下所展现出的动态表观调控特征。
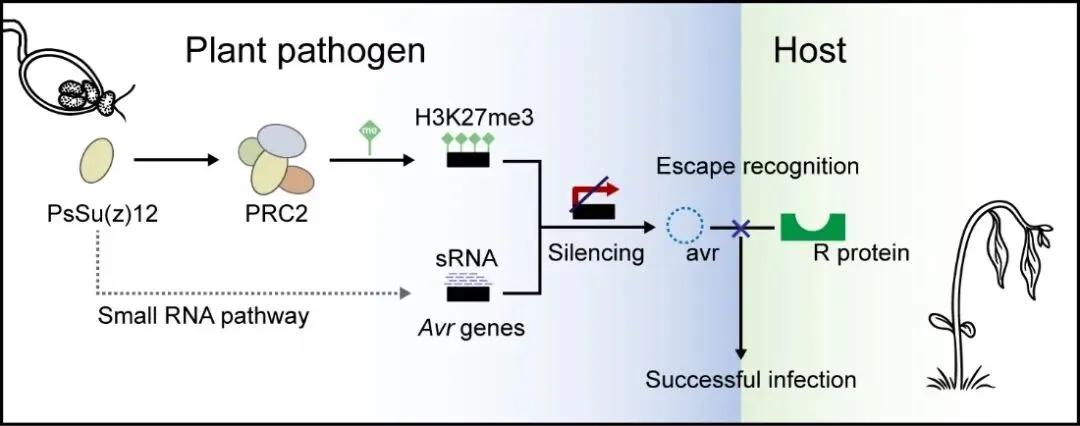
基于上述发现,研究团队提出:在长期与寄主共演化的进程中,植物病原卵菌发展出一种由组蛋白修饰与sRNA共同介导的双重表观遗传沉默机制,用以灵活调控效应子基因的表达,从而高效应对宿主免疫系统的识别压力。而PsSu(z)12作为连接H3K27me3修饰与sRNA通路的关键枢纽因子,不仅深化了我们对病原菌致病策略的理解,也为未来开发新型抗病策略或靶向药剂提供了潜在方向。
该论文第一作者及共同通讯作者为上海交通大学已出站博士后、现任职于南京农业大学的王利媛博士;侯英楠副教授与南京农业大学董莎萌教授为共同通讯作者;加拿大农业及农业食品部Mark Gijzen教授作为重要合作者参与了本项研究。

