中国农业科学院黄峰 Food Hydrocolloids丨当番茄红素遇见肉蛋白:pH值如何决定一场美味的“化学反应”
- 2026-02-14 15:23:33

本研究探究了番茄红素与肌原纤维蛋白在pH依赖条件下的相互作用机制及其对蛋白质结构、胶体稳定性和消化率的影响。结果表明,在中性pH条件下,番茄红素主要通过氢键和范德华力与蛋白质结合,而在酸性/碱性环境下则以疏水相互作用为主导。结构分析显示,番茄红素降低了蛋白质的α螺旋/β折叠含量,增加了无规卷曲结构,并诱导肌球蛋白头尾连接处发生局部解折叠(尤其在pH 7时),但未改变表面疏水性或zeta电位。关键的是,番茄红素的嵌入在防止过度聚集的同时促进了胶体稳定性。分子动力学模拟证实了结构失稳伴随压缩的现象。消化实验表明,pH 7条件下酶可及性的提升显著增强了蛋白质水解和生物活性肽释放,而极端pH值则导致聚集和消化率下降。这些发现揭示了番茄红素可作为pH敏感的肌原纤维蛋白结构调节剂,以优化胶体稳定性和消化率,为设计具有定制化功能的高营养肉制品提供了理论依据。

你有没有想过,为什么在番茄炖牛腩这道菜里,两者搭配起来如此和谐美味?除了味道的融合,在微观世界里,番茄中的明星成分——番茄红素,和牛肉中的肌肉蛋白,正上演着一场精彩纷呈的“分子舞蹈”。科学家们最近深入探究了这场舞蹈的奥秘,他们发现,环境的酸碱度(pH值)就像是舞会的音乐,直接决定了番茄红素和蛋白如何共舞,并最终影响肉的口感和我们的消化吸收。让我们一起钻进微观世界,看个究竟!
第一章:主角登场——舞会上的明星们
首先,让我们认识一下今天舞会的主角们。
一号主角:肌原纤维蛋白(MPs)
你可以把它想象成肉类结构的“钢筋骨架”。它主要存在于肌肉纤维中,是决定肉制品嫩度、保水性和口感(比如嚼劲)的关键蛋白质。我们常说的肌球蛋白就是其中最重要的一员,它长得像一个长长的小蝌蚪,有一个圆圆的“头”和一条螺旋状的“尾巴”。
二号主角:番茄红素(LYC)
这位是来自番茄、西瓜等红色果蔬的“健康明星”,一种脂溶性的天然色素。它最出名的是强大的抗氧化能力,这要归功于它身上那一长串共轭双键,就像一套高效的“自由基灭火器”。
在食品工业中,人们早就尝试将番茄粉或番茄提取物添加到肉制品里,希望能提升产品的颜色和抗氧化性。但背后的分子机制,比如它们俩到底是怎么“看对眼”的?在不同的酸碱环境下舞步有何不同?这场共舞又怎样改变了肉的命运?这篇研究正是为了解答这些有趣的问题。
第二章:舞曲切换——pH值如何改变牵手方式
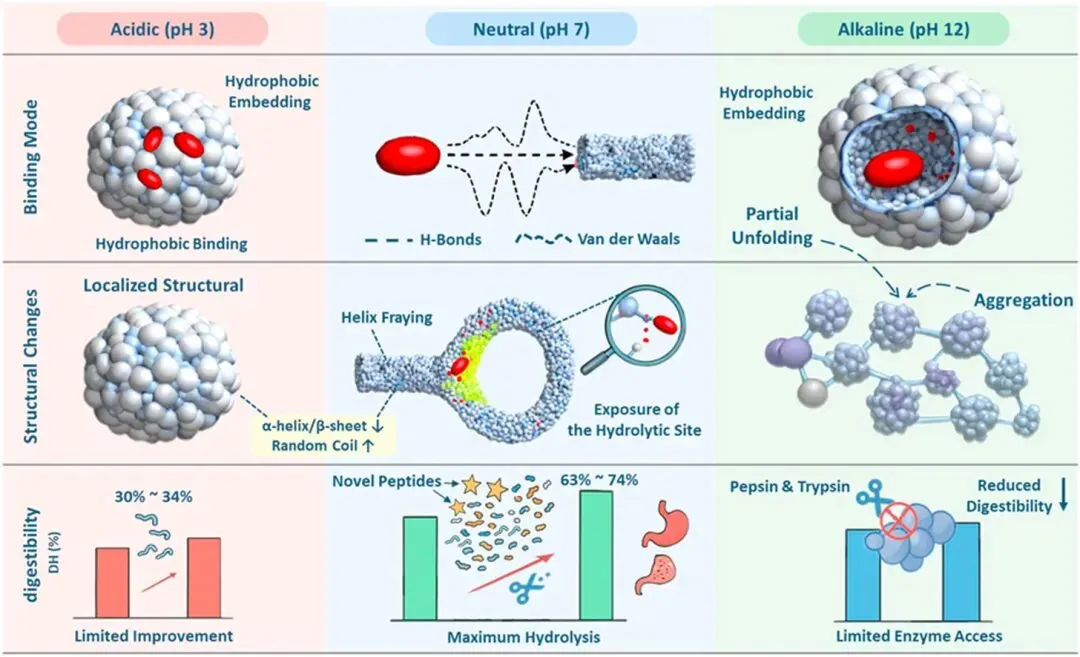
研究人员设定了三个典型的酸碱度环境:酸性(pH 3,类似胃酸环境)、中性(pH 7,类似我们身体的内部环境)和碱性(pH 12,强碱性环境)。结果发现,pH值不同,番茄红素和蛋白之间的“牵手”力量也完全不同!
中性环境(pH 7):君子之交淡如水
在中性环境下,两者的结合主要依靠氢键和范德华力。这就像两个人礼貌地握手,力度适中,不会过分纠缠。这种结合方式非常温和,不会明显改变蛋白质表面的电荷(Zeta电位)和疏水性。
酸性或碱性环境(pH 3/pH 12):热情似火的拥抱
一旦环境变得极端,无论是太酸还是太碱,疏水相互作用就成为了主导力量。这好比两个人都想逃离周围不舒服的环境(水环境),于是紧紧地抱在一起。这是因为在极端pH下,蛋白质的结构会变得松散一些,内部原本藏着的疏水区域会暴露出来,正好与天生讨厌水的番茄红素“惺惺相惜”,一头扎进去。
第三章:共舞的效应——蛋白质“发型”变了
牵手之后,蛋白质本身的“造型”——也就是它的三维结构,会发生什么变化呢?研究人员通过傅里叶变换红外光谱(FT-IR)等技术给蛋白质做了个“发型分析”。
他们发现,无论pH值如何,番茄红素的结合都让蛋白质的α-螺旋和β-折叠结构(规整的“大波浪”和“直发”)减少了,而无规卷曲(随性的“乱发”)增加了。这说明番茄红素让蛋白质的结构从有序变得稍微松散和灵活了。
但最精妙的发现来自计算机模拟的分子动力学分析。模拟显示,番茄红素特别喜欢结合在肌球蛋白那个“小蝌蚪”的头和尾巴的连接处。这个地方就像是一个关键的关节,番茄红素的嵌入,相当于在这个关节处轻轻“撬”了一下,破坏了局部的一些氢键,导致螺旋状的尾巴发生了局部解旋。
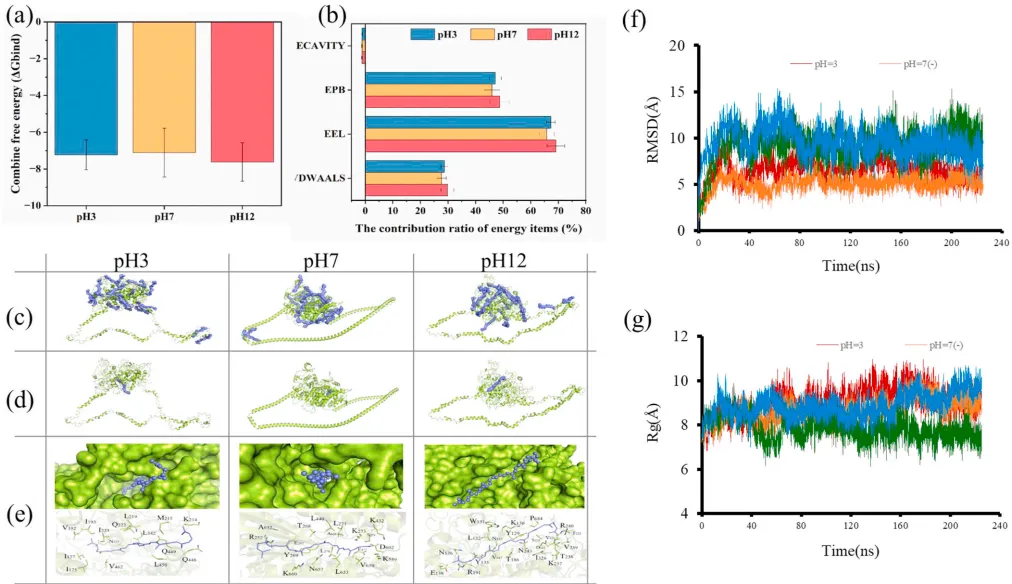
这就好比一个原本扎得很紧的麻花辫,被巧妙地松开了一小段,整体结构还在,但显然更灵活了。这种有针对性的结构松动,为后续的消化埋下了重要的伏笔。
第四章:终极考验——消化吸收的奇妙提升
结构上的变化,最终要接受实践的检验——吃下去后好不好消化?研究人员模拟了人体胃肠消化的过程,结果非常有意思。
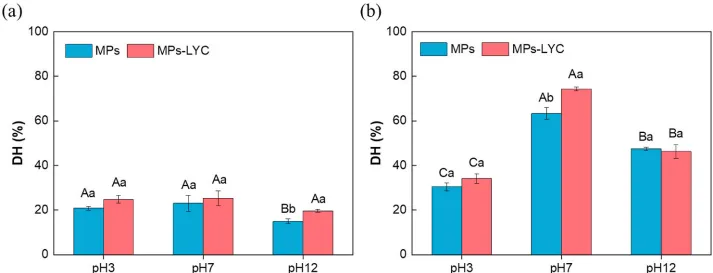
消化实验表明,在中性pH值下与番茄红素结合过的蛋白质,消化率最高!其水解度达到了74%,比没有番茄红素的对照组(63%)显著提升。而在强酸或强碱环境下,虽然结构变化更剧烈,但蛋白质分子之间也容易纠缠在一起(聚集),反而阻碍了消化酶的工作,消化效果提升不明显。
这又是为什么呢?答案藏在“肽组学”分析里。科学家们像做DNA鉴定一样,分析了消化后产生的成千上万种小肽段。
他们发现,中性环境下,番茄红素修饰过的蛋白质被消化后,产生的肽段种类更多,尤其是出现了许多新的、独特的肽段。这些新肽段主要来自肌球蛋白尾巴上的一些特定区域(比如第70-100、410-440、590-740等氨基酸区域)。而这些区域,正是之前被番茄红素“局部解旋”而暴露出来的!消化酶(如胰蛋白酶)更容易找到并切割这些暴露的位点,从而将蛋白质分解得更彻底,生成更多样化的小肽和氨基酸,便于我们吸收。
所以,整个过程可以概括为:中性环境 → 温和的氢键/范德华力结合 → 精准的局部结构松动(尤其肌球蛋白头尾交界处)→ 暴露特定酶切位点 → 消化酶工作效率大增 → 消化率和肽段多样性提高。
结论与启示:给美食家们的科学小贴士
这项研究就像一部精彩的微观世界纪录片,向我们揭示了:
1. pH值是总导演:它决定了番茄红素和肉蛋白之间的相互作用力,中性环境下的“君子之交”效果最好。
2. 结构微调是关键:番茄红素不是一个粗暴的“破坏者”,而是一个精准的“结构调节师”,它通过局部解旋肌球蛋白,为消化酶创造了最佳工作条件。
3. 健康双赢:这种结合不仅可能提高了蛋白质的消化吸收率,让我们从肉食中获取更多营养,同时番茄红素本身也能得到蛋白质的“保护”,更好地发挥其抗氧化活性。
所以,下次你再享用番茄牛腩、番茄鱼片时,除了品尝其美味,也可以会心一笑,因为你知道在微观世界里,正发生着如此巧妙而有益的“分子合作”。这项研究也为开发更营养、更易吸收的功能性肉制品提供了全新的思路——或许未来,我们可以通过精确控制pH值,来定制化地优化食物中营养成分的释放和吸收。
作者简介:
黄峰博士 商丘市梁园区人,研究员,博士生导师。2002 年毕业于商丘市第二高级中学,2012 年获南京农业大学工学博士学位。现就职于中国农业科学院农产品加工研究所,主要从事肉品加工与质量控制研究。主持国家自然科学基金项目、国家重点研发计划课题、新疆天山青年拔尖人才计划、企业成果转化课题等20余项,第一或通讯作者发表论文50余篇;授权国家发明专利30余件;制定农业行业标准、团体标准等10余项;获神农中华农业科技一等奖、轻工业联合会一等奖、商联合特等奖等奖励8项。
黄峰博士 商丘市梁园区人,研究员,博士生导师。2002 年毕业于商丘市第二高级中学,2012 年获南京农业大学工学博士学位。现就职于中国农业科学院农产品加工研究所,主要从事肉品加工与质量控制研究。主持国家自然科学基金项目、国家重点研发计划课题、新疆天山青年拔尖人才计划、企业成果转化课题等20余项,第一或通讯作者发表论文50余篇;授权国家发明专利30余件;制定农业行业标准、团体标准等10余项;获神农中华农业科技一等奖、轻工业联合会一等奖、商联合特等奖等奖励8项。


