中国农业科学院植物保护研究所团队EST|跨代危害突破传统安全阈值:ryr1b 基因高甲基化介导嘧菌酯亚阈值暴露诱导的斑马鱼跨代发育毒性
- 2026-02-14 09:59:39

文章信息
第一作者:常一明,朱丽珍
通讯作者:蒋红云 研究员,刘新刚 研究员
通讯单位:中国农业科学院植物保护研究所
https://pubs.acs.org/doi/10.1021/acs.est.5c16961
亮点
• 证实了亚阈值嘧菌酯暴露可致后代斑马鱼跨代发育毒性。
• 阐明了ryr1b 基因内含子高甲基化可跨代稳定遗传,是跨代毒性的核心表观遗传位点。
• 揭示了ryr1b 介导钙信号通路,调控心肌兴奋-收缩偶联相关基因表达路径。
• 明确了低剂量污染物经表观遗传机制引发后代发育异常的核心机制。
研究进展
众多研究表明,生物接触化学物质的代际负面影响与表观遗传调控相关,嘧菌酯作为广泛应用的广谱杀菌剂,在水体中普遍检出且对水生生物具有多种毒性,但其亚阈值暴露的跨代效应此前尚不明确,厘清该问题对农药生态风险评估至关重要。本研究对斑马鱼进行 1、10、100 μg/L 嘧菌酯亚阈值暴露(4 天),发现 F0 代胚胎无明显毒性效应,而未暴露的 F1、F2代胚胎/仔鱼出现畸形率升高、心跳减少、体长受抑等发育异常,且该效应与亲本性别无关,证实嘧菌酯对斑马鱼具有跨代发育毒性。进一步研究显示,F1、F2 代 DNA 甲基转移酶蛋白水平降低,基因组甲基化模式改变,ryr1b 基因呈表达抑制与高甲基化同步特征,且甲基化位点跨代一致,并通过钙信号通路调控心肌细胞兴奋-收缩耦合相关基因,引发心脏功能缺陷(图1)。
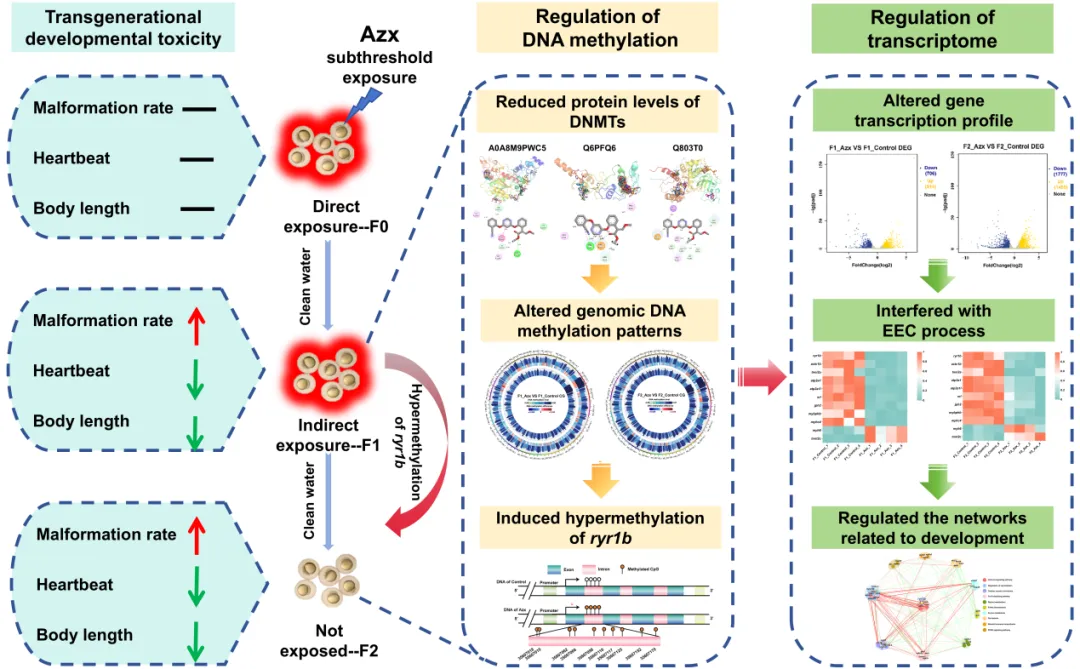
图1 图文摘要
通过将F0代斑马鱼胚胎暴露于一系列嘧菌酯溶液,明确嘧菌酯对斑马鱼胚胎发育畸形、心跳抑制和体长缩短的无观察效应浓度(NOEC)分别为 200、200 和 150 μg/L(图2B)。因此,认为在低于 NOEC 的浓度下接触嘧菌酯不会导致斑马鱼胚胎出现上述发育异常。然而,当斑马鱼F0代胚胎经低于嘧菌酯NOEC 的 1、10、100 μg/L浓度暴露 4 天后全程用清水饲养至 F2 代,F0 代胚胎未出现不良影响,但未直接接触嘧菌酯的 F1、F2 代胚胎,出现显著的发育畸形、心跳抑制及体长缩短现象,且呈浓度依赖性(图2A、C)。F1、F2 代胚胎在多个时间点的畸形率均显著高于对照组,心跳次数普遍低于对照组,体长在中、高浓度暴露组存在显著缩短(图2C-D)。上述结果证实,嘧菌酯亚阈值暴露对亲代斑马鱼无明显影响,却对后代胚胎具有跨代发育毒性,且该毒性至少持续两代。
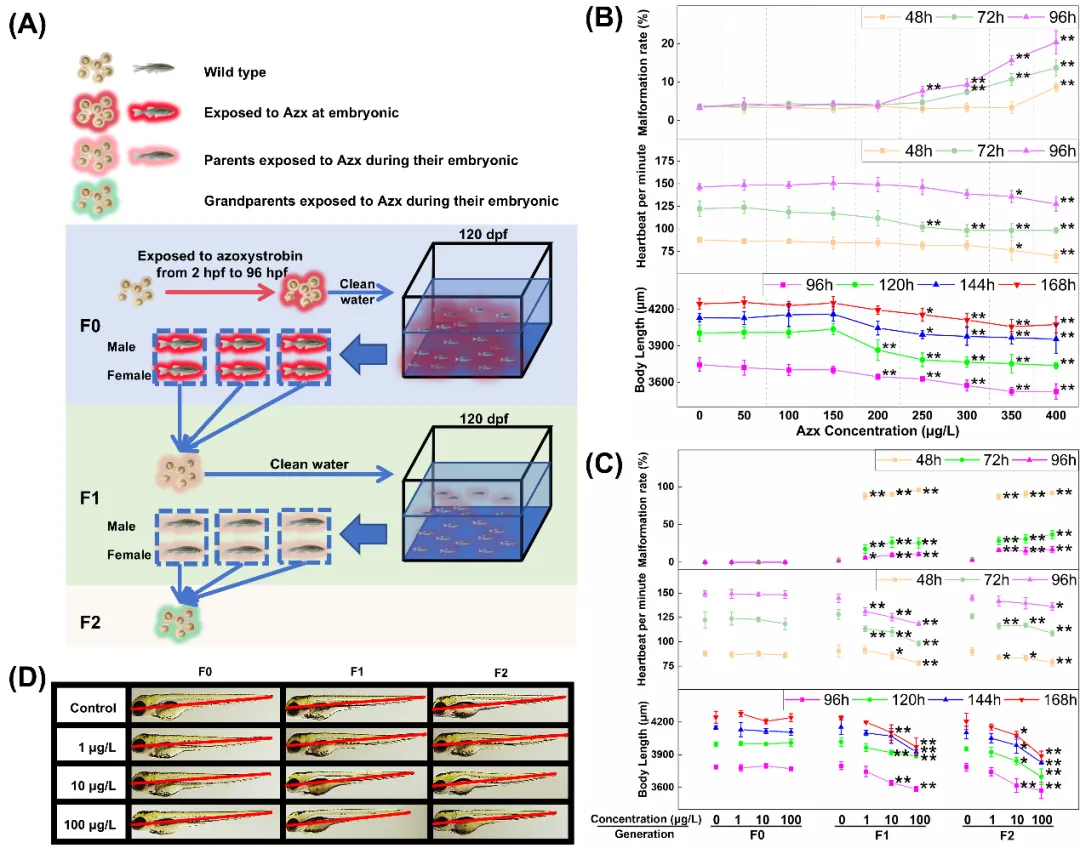
图2 A. 跨代毒性实验方法示意图。B. 从 2 小时前期至 7 天前期暴露于 嘧菌酯 的斑马鱼胚胎的急性毒性。C. 不同时间点对 F0、F1 和 F2 代的畸形率、心跳和体长的影响。D. F0、F1 和 F2 代在 96 小时前期的典型体长图像。
测定了 F1、F2 代胚胎中 DNMT1、DNMT3A、DNMT3B 三种 DNA 甲基转移酶的蛋白质水平,发现与对照组相比,所有暴露组的这三种 DNMT 蛋白水平均受显著抑制,且呈浓度依赖性(图3A)。分子对接测试显示,嘧菌酯具备与 DNMT1 和 DNMT3B 蛋白结合的能力,推测其可能通过与 DNMT 的空间构型结合发挥抑制作用(图3B-C)。SPR(表面等离子共振) 技术进一步证实,嘧菌酯与这三种蛋白质均表现出强结合亲和力(图D-F)。综上,明确嘧菌酯暴露对三种 DNA 甲基转移酶的抑制具有跨代效应,提示 DNA 甲基化可能在其跨代发育毒性中发挥作用。
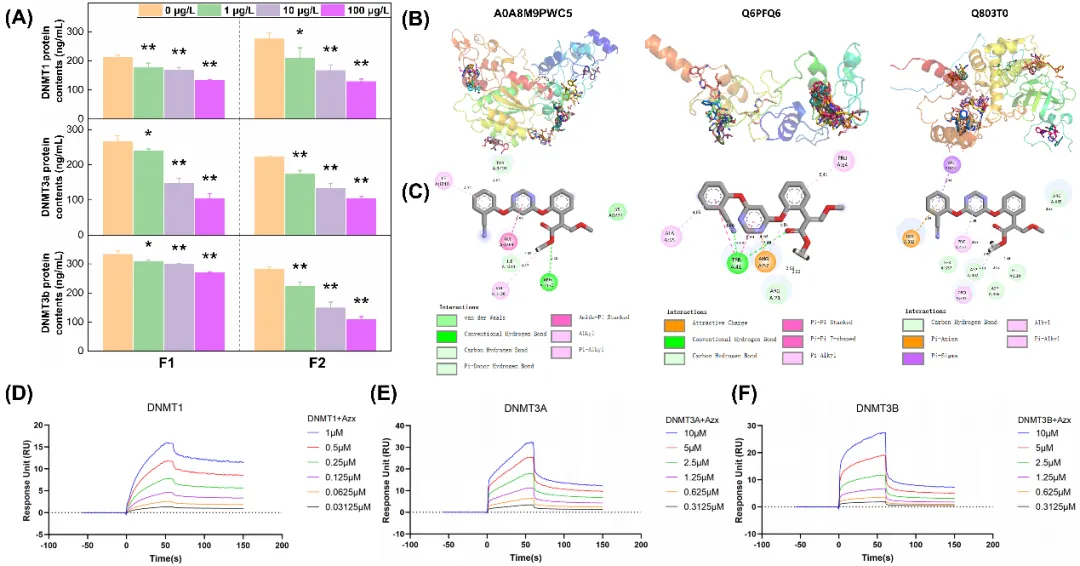
图3 A. F1 和 F2 代中 DNMT1、DNMT3A 和 DNMT3B 的蛋白含量。B. 嘧菌酯分子-DNMTs蛋白质对接构象的分布情况。C. 最高得分构象的二维图。嘧菌酯与 DNMT1(D)、DNMT3A(E)和 DNMT3B(F)的物理结合情况。
为验证 DNA 甲基化是否参与嘧菌酯诱导的跨代发育毒性,对 F1、F2 代斑马鱼胚胎开展全基因组 DNA 甲基化检测。结果显示,暴露组全基因组甲基化水平在对照组与暴露组间无显著差异,但特定基因组区域存在显著变化,如 F1 代启动子、外显子及 CGI 区甲基化水平低于对照组,F2 代外显子及 CGI 区甲基化水平低于对照组(图4A-B)。两代胚胎中均检测到差异甲基化区域(DMRs),且分布模式相似,以低甲基化区域为主,与两代 DNA 甲基转移酶含量下降一致,表明低剂量嘧菌酯暴露可调控子代全基因组甲基化,且影响具有代际传递性(图4C)。通过两代差异甲基化基因(DMGs)交集分析,筛选出共同差异甲基化基因,这些基因富集于早期发育及心血管系统调控相关通路,提示这些通路异常可能是子代发育及心跳异常的原因(图4D-F)。
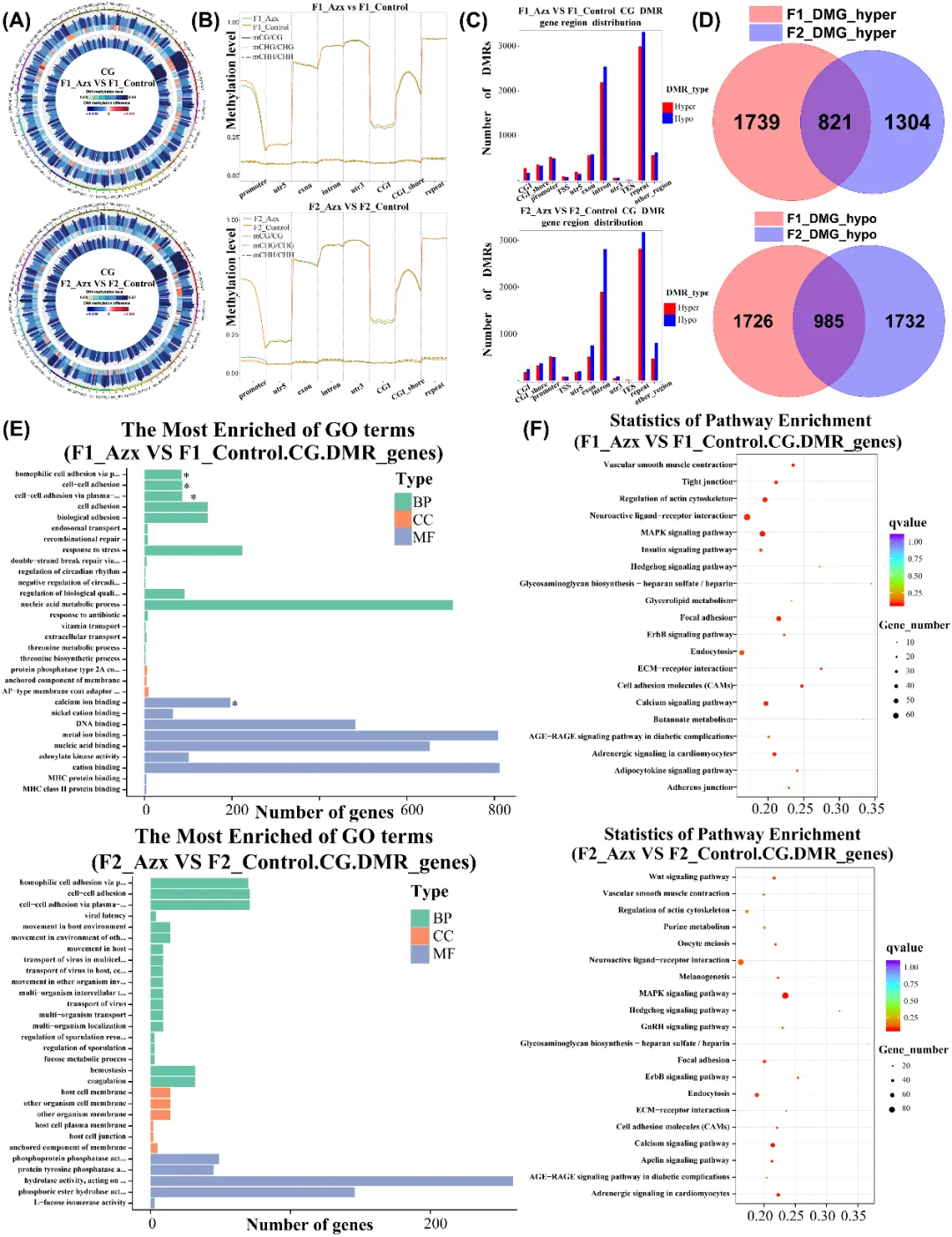
图4 A. DNA 甲基化circos图。B. 3 种序列环境的综合展示。C. DMR 基因区域分布。D. F1 和 F2 代中高甲基化和低甲基化差异甲基化区域的Veen图。E. GO富集通路分析图。F. KEGG富集通路分析图。
转录组学分析表明,与对照胚胎相比,F1 胚胎中共有 1620 个差异表达基因,而在 F2 胚胎中则共发现 3232 个差异表达基因(图5A)。通过两代差异基因交集分析,筛选出共有的差异表达基因,其变化趋势在两代中一致(图5B)。进一步的 GO 和 KEGG 通路分析表明,多个与内质网离子稳态相关的通路受到影响,且亲代暴露显著改变了子代的解毒代谢过程。同时,与早期发育密切相关的叶酸生物合成通路,以及对发育和心脏功能至关重要的肌肉收缩、肾上腺素信号通路均出现异常。这些通路的紊乱与子代胚胎发育异常、心跳减少密切相关,表明其参与了嘧菌酯诱导的跨代胚胎畸形。此外,两代共有的差异甲基化基因富集通路中,心肌细胞肾上腺素信号通路也受显著影响,提示转录组变化可能受 DNA 甲基化修饰调控(图5C-D)。
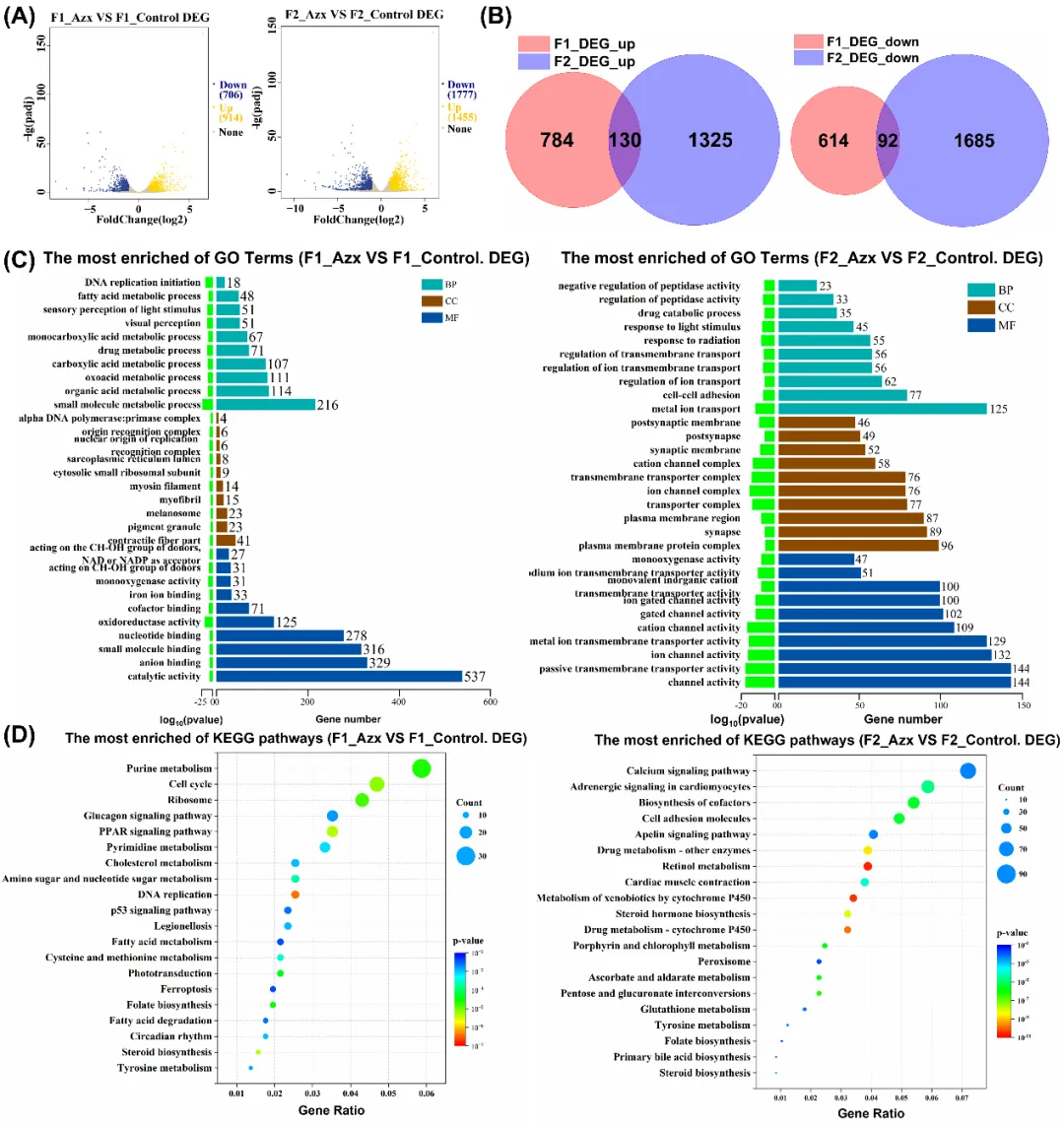
图5 A. 火山图。B. F1 和 F2 代中共上调和共下调差异表达基因的Veen图。GO(C)和 KEGG(D)富集通路分析图。
开展全基因组 DNA 甲基化与转录组的整合分析,结果显示,F1、F2 代胚胎中共有 10 个基因同时为差异甲基化基因(DMGs)与差异表达基因(DEGs),其中 7 个基因的甲基化与基因表达趋势在两代中一致,提示 DNA 甲基化与基因表达存在潜在关联(图6A)。进一步分析这 10 个基因的差异甲基化区域,以筛选可跨代稳定遗传的位点。结果表明,仅 ryr1b 基因的差异甲基化区域在两代中完全一致,且其内含子区域的 10 个差异甲基化位点里,8 个的甲基化变化趋势在两代中相同,证实 ryr1b 的甲基化修饰可跨代稳定遗传(图6B-C)。开展基因互作网络分析,发现 ryr1b 在网络中处于核心位置,联合调控钙信号通路及心肌细胞兴奋-收缩耦合相关基因,触发级联反应,影响细胞骨架、FoxO 信号通路、视黄醇相关通路等与发育密切相关的通路,这些通路相互作用,导致胚胎发育毒性的跨代传递(图6D-E)。相关性分析进一步证实心肌细胞兴奋-收缩耦合相关基因的表达变化与两代胚胎中心脏功能减弱的表型之间存在显著关联(图6F)。
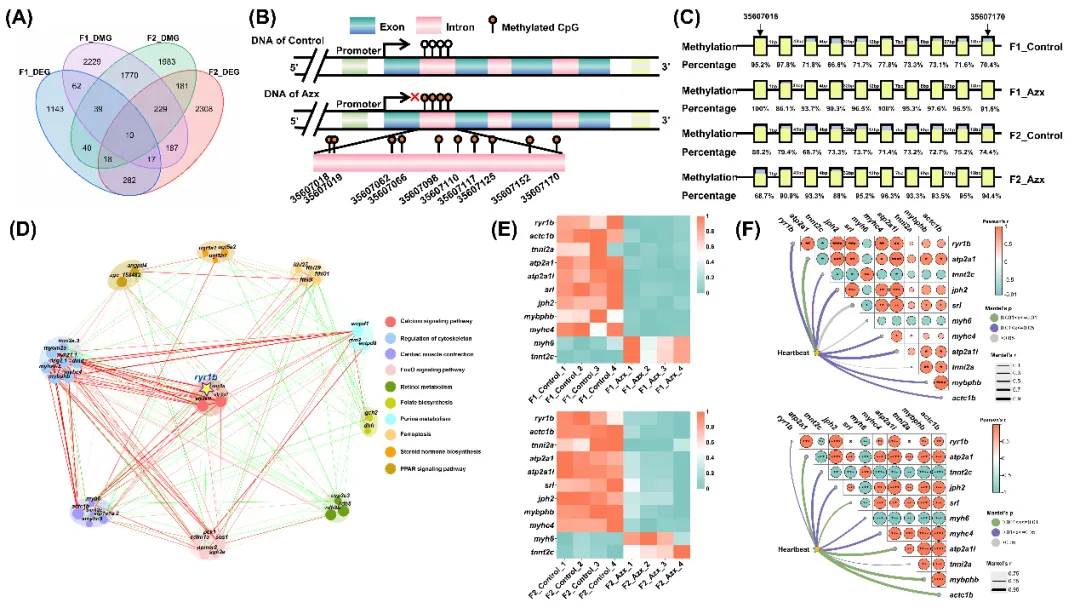
图6 A. F1和F2 代DEG和DMG的 Venn 图。ryr1b 基因的 DNA 甲基化区域(B)和位点(C)。D. F1 和 F2 代重叠部分的 DEG 的通路相互作用网络图。E. 在兴奋-收缩耦合(ECC)过程中富集的 DEG 的热图。F. 基于 72 小时胚胎心跳的曼特尔检验相关热图。
综上,揭示嘧菌酯对斑马鱼胚胎的跨代发育毒性机制为:亲代胚胎接触嘧菌酯,使子代胚胎 DNA 甲基转移酶减少,全基因组 DNA 甲基化异常,导致 ryr1b 基因内含子高甲基化,其 mRNA 表达和 RyR 蛋白合成下降。RyR 蛋白减少影响钙离子释放,引发细胞质钙离子不足,无法有效触发肌丝滑动,心肌收缩力减弱。同时,ATP 代谢紊乱破坏钙循环,加重心脏舒张功能障碍,心率降低。而 ryr1b 的高甲基化可跨代传递,调控心肌兴奋 - 收缩偶联通路,最终导致子代胚胎心脏功能受损,引发跨代发育毒性(图7)。
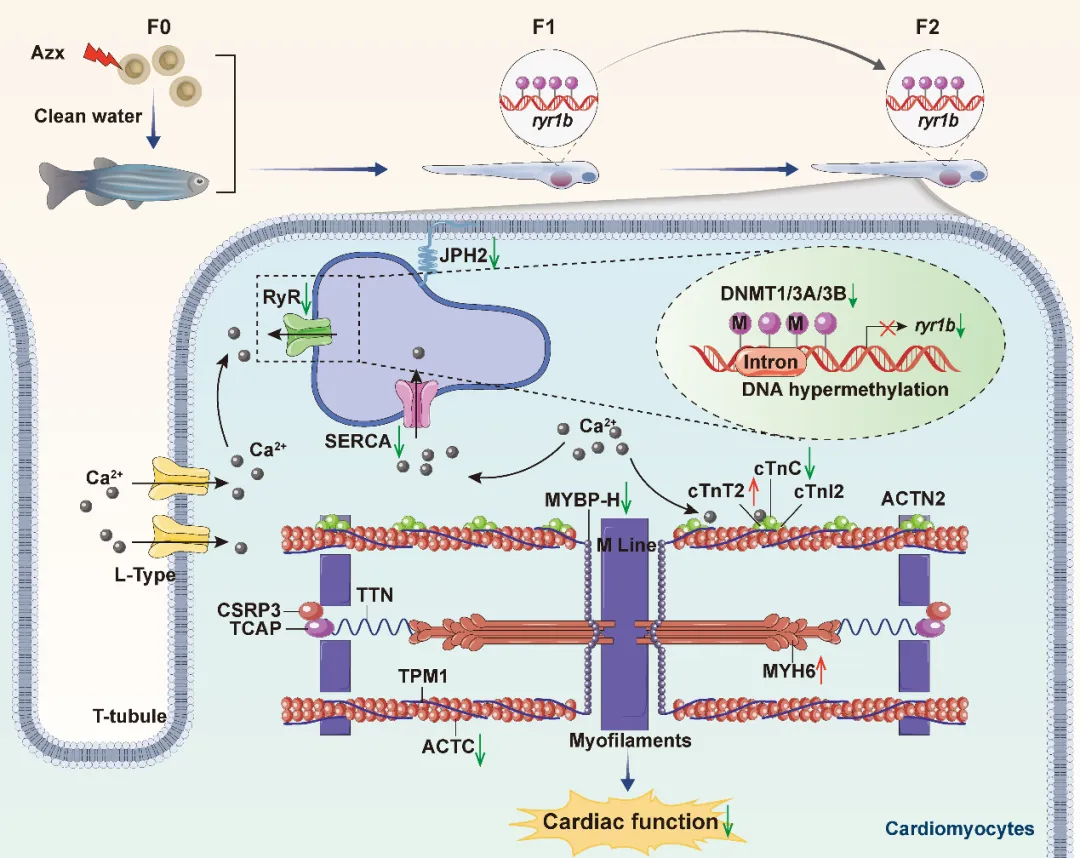
图7 嘧菌酯诱导的斑马鱼跨代发育毒性机制图
本研究首次揭示嘧菌酯亚阈值暴露对斑马鱼当代无影响、却致后代跨代发育毒性的特性,精准识别驱动该效应的核心 DNA 甲基化修饰位点,清晰阐明亲代胚胎暴露诱导子代发育缺陷的表观遗传机制。这一发现为揭示环境污染物跨代影响生物健康与遗传特性提供关键分子机制和重要线索,同时丰富了低剂量污染物生态风险的理论认知,为全面评估农药长期生态风险、构建精准的生态风险评估体系奠定坚实基础。
作者介绍
朱丽珍,博士,中国农业科学院植物保护研究所副研究员,硕士生导师。主要从事农药环境毒理等研究。主持国家重点研发计划项目子课题、国家自然科学基金面上、青年基金等多个项目。以第一作者在Environ. Sci. Technol.、Environ. Pollut.、Aquat. Toxicol.、Ecotoxicol. Environ. Saf.等期刊发表多篇SCI论文。
刘新刚,博士,中国农业科学院植物保护研究所研究员,博士生导师。国家高层次人才、中国农业科学院农科英才创新型领军人才。植物病虫害综合治理全国重点实验室副主任、农业农村部农药评价重点实验室副主任。主要从事农药环境行为、生态毒理、农药污染防控等研究。主持国家重点研发计划项目、挪威政府项目、国家自然科学基金国际合作、面上、青年基金等10余项。在Water Res.、Biochar、Environ. Sci. Technol.等发表第一作者或通讯作者SCI论文100余篇。
通讯邮箱:liuxingangal@caas.cn
投稿、转载、合作可在后台留言(备注:微信号)或发邮件至sthjkx1@163.com
| 2.【视频】 | |
| 4.【水】 | |
| 5.【气】 | 13.【Science】 |
| 6.【土】 | 14.【WR】 |
| 15.【EST】 | |
| 16.【JHM】 |
