摘 要:MYB转录因子作为植物中最大的转录因子家族之一,在调控园艺植物芳香化合物生物合成过程中发挥着核心作用。近年来,研究已明确MYB成员通过直接结合结构基因启动子或与bHLH、WD40等蛋白互作形成复合体,从而精确调控萜类、苯丙素类及脂肪酸衍生物等关键芳香物质的合成代谢。本文中系统综述了近十年来MYB在芳香化合物合成调控网络中的功能与机制,重点总结了其在模式植物及重要园艺作物中的调控路径,并对环境因子与MYB介导的香气合成调控提出了展望。关键词:MYB;转录因子;调控;芳香化合物;园艺植物芳香化合物不仅为园艺植物赋予独特的香气和风味,并在其生长、繁殖和自我保护中发挥关键作用。MYB作为植物中最大的转录因子家族之一,因其多样性高和重要的生物学功能而备受关注。它们在调控植物生长发育、代谢过程以及响应生物和非生物胁迫方面发挥着重要作用。随着研究的深入,对MYB转录因子在调控植物芳香化合物次生代谢途径上的认识日益加深。本文中综述了近十年来MYB转录因子在园艺植物芳香化合物次生代谢合成调控中的研究进展,以期为相关研究提供参考。1 园艺植物主要挥发性芳香物质
1.1 园艺植物主要挥发性芳香物质种类
植物芳香化合物通常是指植物体内合成并释放的一类具有挥发性且分子量较小的有机化合物,广泛存在于叶片、果实、花朵等营养与生殖器官中。这些物质沸点较低,易于散发,构成了植物特有的气味。根据生物合成途径,植物挥发物主要可分为三大类:萜类、苯丙素/苯类和脂肪酸衍生物(Mummadireddy et al.,2017)。
1.1.1 萜类化合物
目前已经在植物中发现和鉴定超过1 700种天然香气化合物,萜类化合物是其中最大的一类,主要包括单萜、倍半萜、脱辅基类胡萝卜素等(Dong & Lin,2021)。萜类化合物根据C5类异戊二烯单元,可被分为C5(半萜)、C10(单萜)、C15(倍半萜)、C20(二萜)、C25(倍半萜)、C30(三萜)、C40(四萜)和> C40(多萜类)(Ashour et al.,2010)。在高等植物中,萜类物质的合成途径主要通过两条独立的代谢通路来完成,分别是甲羟戊酸(MVA)途径和2-C–甲基–D–赤藓糖–4–磷酸(MEP)途径(Shi et al.,2018)。MVA途径主要发生在细胞质中,而MEP途径主要在叶绿体中,它们的产物都是异戊烯焦磷酸(IPP)和其同分异构体二甲基丙烯焦磷酸(DMAPP),这两种分子是所有萜类化合物的基本构建单元。
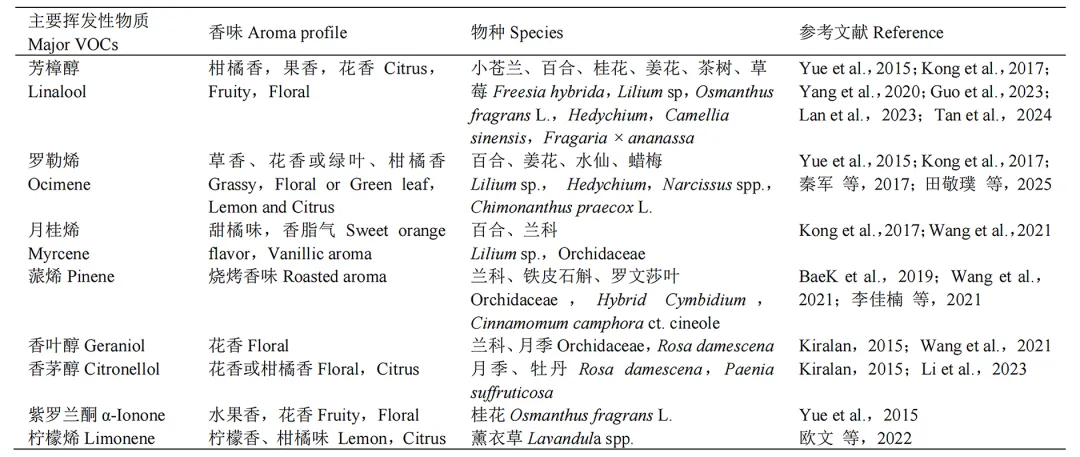
在园艺植物中,单萜类化合物是一类重要的芳香物质,广泛存在于花朵和果实中,是构成其典型气味的主要成分。单萜类化合物在生物合成上起源于香叶基二磷酸(GPP,C10),该过程由GPP合成酶催化,通过头尾缩合反应将一分子异戊烯基焦磷酸(IPP)和一分子二甲基烯丙基焦磷酸(DMAPP)转化为GPP(Ogura & Koyama,1998)。常见的单萜类化合物包括芳樟醇、罗勒烯、月桂烯、α–蒎烯、香叶醇、香茅醇、紫罗兰酮和柠檬烯等(表1)。
表1 园艺植物中主要萜类化合物
目前,园艺植物芳香成分的研究仍主要集中于单萜类物质,而对其他萜类(如倍半萜、二萜等)的关注相对有限,其分布、代谢途径及功能仍有待进一步探索。
1.1.2 苯丙素/苯类化合物
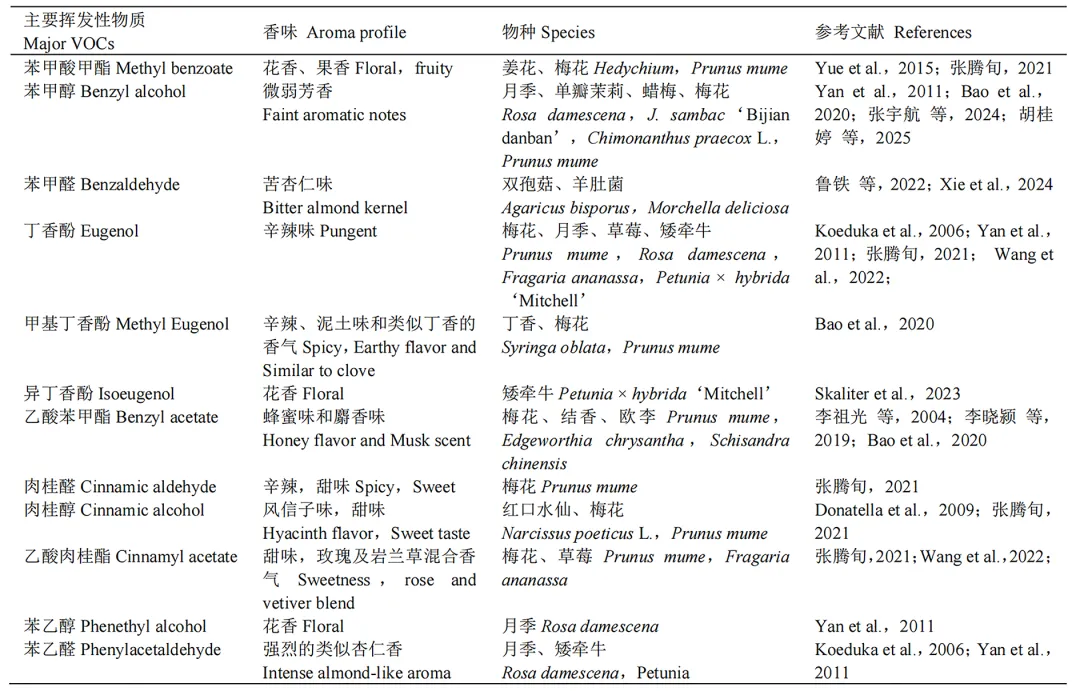
植物挥发性有机化合物VOCs中的第二大类是苯丙素/苯类化合物。挥发性苯丙素/苯环类化合物通常具有两种结构类型:一是在C9位含有还原态羧基(如醛类、醇类或烯烃类);二是在苯环的羟基或羧基上引入烷基取代基(即醚类和酯类)(Mostafa et al.,2022)。苯丙素/苯类化合物主要来源于前体物质芳香族氨基酸苯丙氨酸(Phenylalanine,Phe)。根据其碳骨架结构的不同,该类又分为3个亚类:C6-C3骨架苯丙素类、C6-C2骨架的苯丙素衍生物类和C6-C1骨架的苯类化合物(Muhlemann et al.,2014)。Phe通过莽草酸途径合成后进入苯丙烷代谢通路。该通路生物合成的关键起始步骤由苯丙氨酸解氨酶(PAL)催化,PAL介导L–苯丙氨酸脱氨生成反式肉桂酸(t-CA)(Orlova et al.,2006)。反式肉桂酸作为核心前体,通过一系列酶促反应(涉及BALDH、BPBT、KAT等多种酶)逐步转化为多种中间代谢物,例如苯甲醛(Benzaldehyde)、苯甲酸(Benzoic acid)和香草酸(Vanillic acid)等。这些中间体最终被合成为结构多样的苯丙素/苯类化合物,主要包括苯乙酸苯甲酯(Benzyl phenylacetate)、丁香酚(Eugenol)及其甲基化产物,如甲基丁香酚(Methyleugenol)等。研究表明,过氧化物酶体是该途径的一个核心反应场所(Qualley et al.,2012),其内部通过高效的酶分工与区域化催化,协调多种反应的进行,从而实现了芳香族挥发性物质的定向与高效合成。此外,苯丙氨酸还可以通过不依赖PAL的代谢途径生成苯乙醛(Phenylacetaldehyde)、苯乙醇(Phenylethanol)等苯丙素衍生物(Hirata et al.,2012)。
表2 园艺植物中主要苯丙素/苯类化合物化合物
1.1.3 脂肪酸衍生物
脂肪酸衍生物来源于不饱和C18脂肪酸,亚麻酸和亚油酸。研究表明,植物挥发性脂肪酸衍生物的生物合成主要涉及四条酶促途径,包括脂氧合酶(LOX)、氢过氧化物裂解酶(HPL)、丙二烯氧合酶(AOS)以及乙醇脱氢酶(ADH)。该过程始于脂氧合酶(LOX)催化多不饱和脂肪酸(如亚油酸和亚麻酸)发生区域与立体特异性的氧化,生成9–或13–氢过氧化物中间体。这些中间产物可进入LOX途径的两个分支,进而形成不同的挥发性化合物。其中,丙二烯氧合酶(AOS)特异性作用于13–氢过氧化物,将其转化为不稳定的环氧化物,继而通过环化、还原等反应生成茉莉酸(JA)。相反,氢过氧化物裂解酶(HPL)可裂解9–或13–氢过氧化物,生成挥发性C6或C9醛[如己醛、(E)-2–己烯醛、(E)-2–壬烯醛]并释放相应的氧代酸。这些醛类可进一步作为乙醇脱氢酶(ADH)的底物,被还原生成相应的醇类[如己醇、(Z)-3–己烯醇],并可经酯化反应形成酯类挥发物(Noordermeer et al.,2001;Schwab et al.,2008;Muhlemann et al.,2014)。表3 园艺植物中脂肪酸衍生物
MYB转录因子的N端含有一个高度保守的DNA结合域,即MYB结构域。该结构域通常由1 ~ 4个不完全重复序列(R)组成,每个重复约含50 ~ 53个氨基酸残基,可折叠形成3个α–螺旋,其中第二和第三螺旋构成螺旋—转角—螺旋(helix–turn–helix,HTH)拓扑结构。在HTH结构中,每间隔约18 ~ 19个氨基酸会出现3个保守的色氨酸Trp残基(在部分植物R2R3-MYB中可能被苯丙氨酸Phe、亮氨酸Leu等疏水氨基酸替代),共同形成一个疏水核心,对维持结构稳定性具有关键作用。第3个α-螺旋为“识别螺旋”,可嵌入DNA大沟,特异性识别并结合靶基因启动子中的顺式元件(如C/TAACG/TG序列),从而启动或抑制转录。与高度保守的N端相反,MYB转录因子的C端序列变异较大,常包含转录激活或抑制域,并可通过该区域与多种蛋白互作,参与调控植物次生代谢(如苯丙烷途径、花青素合成)、生长发育(如细胞分化、器官建成)、逆境响应(如干旱、高盐、低温胁迫)以及激素信号转导等多种生物学过程(蓝卡尔等,2023)。根据不完全重复序列的数量,可将MYB分为4个亚家族:1R-MYB(MYB-related)、2R-MYB (R2R3-MYB)、3R-MYB(R1R2R3-MYB)和4RMYB。其中,2R-MYB是最大的一个亚家族,被认为是由3R-MYB中R1重复序列的缺失或1R-MYB的复制演变而来的(Jiang et al.,2004)。只拥有一个或部分不完全重复序列的MYB蛋白被称为1R-MYB(MYB-related),是第二大亚家族。这些1R-MYB(MYB-related)蛋白广泛分布于植物中,它们参与控制植物的各种过程,包括细胞形态发生、次生代谢、叶绿体发育和对磷酸盐饥饿的反应(Rosinski & Atchley,1998)。3R-MYB是第三大亚家族,它们在进化上相对保守,研究发现植物3R-MYB因子与细胞周期调控和发育控制有关(Ito,2005)。4R-MYB亚家族是MYB家族中最小的一组,包含4个R1/R2重复序列。2.2 MYB转录因子的生物学功能
2R-MYB家族成员最多、分布最广,其功能最为多样,涵盖次生代谢(如调控花青素和黄酮类化合物的合成)、细胞形态建成(如调控表皮蜡质合成)、激素应答及非生物胁迫响应等过程。2R-MYB转录因子之间以及与其他类型的转录因子,如bHLH、WD40等,可以通过形成MYB-bHLH-WD40(MBW)蛋白复合物的形式共同参与基因表达的精细调控(Yang et al.,2022)。例如,番茄果实中花青素的积累受MBW复合物的调控:一方面,bHLH转录因子SlJAF13可以直接激活另一个bHLH转录因子SlAN1基因的表达,促进MBW复合体的形成,从而正调控花青素合成;另一方面,JA信号抑制因子SlJAZ2能够通过与上述bHLH转录因子相互作用,干扰MBW复合物的形成,从而负调控花青素合成;此外,SlJAZ2基因的表达还受SlJAF13转录因子负调控,如此形成对番茄果实花青素合成的精细调节(Chen et al.,2022)。含有3个MYB结构域的R1R2R3-MYB(3R-MYB)成员较少,主要参与细胞周期调控和分化过程,例如水稻OsMYB3R-2可通过调控细胞周期蛋白及逆境相关基因的表达增强耐冷性(Ma et al.,2009)。仅含一个MYB结构域的1R-MYB(MYB-related)蛋白功能也较为多样,包括维持端粒稳定性、调控光形态建成和生物钟,以及参与花器官发育等。例如,水稻OsMYB1R1负调控植株的抗旱能力,该基因的表达受干旱胁迫下调,且在不同组织中表达水平不同,在稻穗中表达量较高。在正常生长条件下,过量表达和干扰表达OsMYB1R1的水稻转基因植株与野生型(WT)植株在表型、生理指标和农学性状方面均未见差异,但是在干旱胁迫下,干扰表达OsMYB1R1的水稻植株表现出更高的耐旱性和复水后的存活率,过表达植株则相反(Peng et al.,2022)。而4R-MYB亚家族成员数量最为稀少,目前仅在拟南芥、杨树等少数物种中发现,其具体功能尚不明确,有待进一步研究。总体而言,不同MYB亚家族的功能差异主要源于其MYB结构域的数量和组成,这决定了它们与DNA结合的特异性及蛋白质互作能力,进而介导了多样化的生物学过程。为了更清晰地展示MYB转录因子类型和功能的关系,搜集已有报道的园艺植物芳香物质合成调控相关MYB转录因子,与模式植物拟南芥、水稻中4种典型的MYB因子共同构建进化发育树,如图1所示,参与调控芳香化合物生物合成的MYB转录因子主要归属于2R-MYB亚家族,同时也有少数成员属于1R-MYB和4R-MYB类型。3 MYB转录因子调控园艺植物芳香物质代谢
3.1 萜类芳香物质的合成
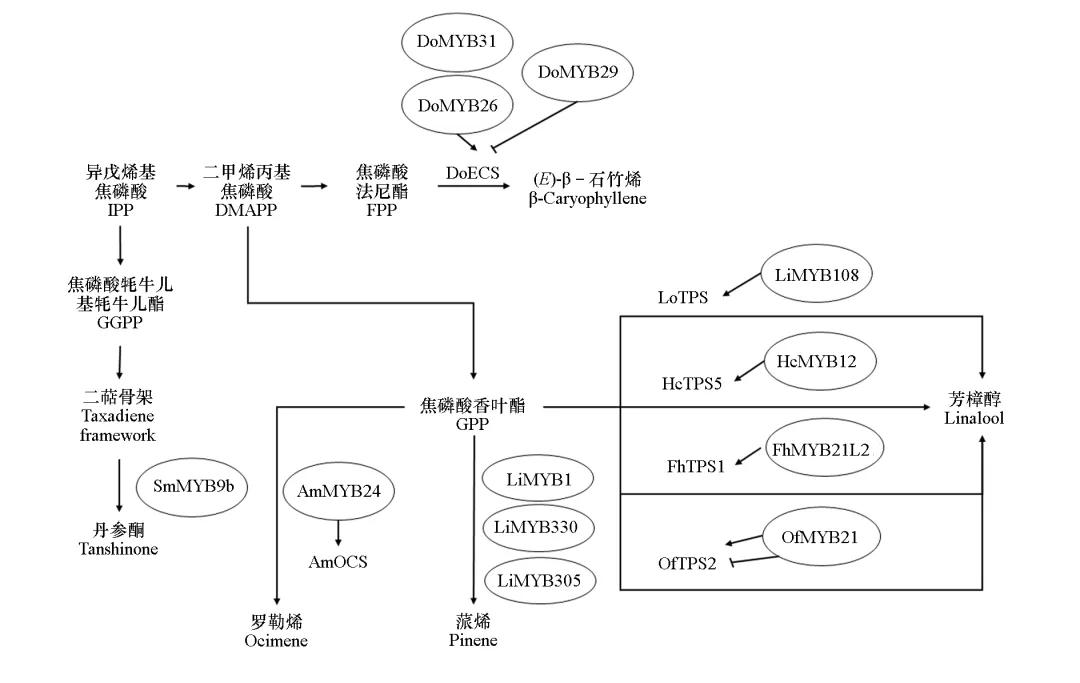
已有研究表明,MYB转录因子主要通过调节萜烯合酶基因的表达实现对园艺植物萜类芳香化合物合成的调控,MYB常会与其他转录因子互作,精准调控下游基因的表达(图2)。例如,芳樟醇是小苍兰(Freesia hybrida)花朵释放的挥发性混合物中最主要的成分,由单萜合酶TPS1催化形成。研究表明,小苍兰的FhMYB21L2属于2R-MYB型转录因子(图1),能够直接与FhTPS1的启动子结合,正调控芳樟醇的合成,而FhMYC2能够与FhMYB21L2相互作用,抑制FhTPS1的表达(Yang et al.,2020)。Zhang等(2025)还发现另外2个转录抑制子FhAP2和FhACE1(bHLH转录因子)均可以与FhMYB21L2相互作用,削弱其与靶基因FhTPS1启动子的结合能力,从而负调控芳樟醇的合成。此外,FhAP2和FhACE1也以类似的机制参与花青素合成途径的调控(Zhang et al.,2025)。萜类化合物也是‘西伯利亚’百合(Lilium‘Siberia’)花香的主要组成成分。研究鉴定了3个R2R3-MYB转录因子LiMYB1、LiMYB305和LiMYB330,过量表达这3个LiMYB的百合花朵中,主要单萜(如芳樟醇和蒎烯)的释放增加,而沉默LiMYB时单萜的水平降低;这3个LiMYB转录因子都可以结合并激活百合单萜合酶基因LiTPS2的启动子;研究还发现LiMYB308和LiMYB330可以与LiMYB1相互作用,提高单个LiMYB转录因子的转录活性,表明它们在调控花香萜类生物合成中发挥协同作用(Guo et al.,2023)。芳樟醇是桂花花香化合物中的重要组成成分。桂花中R2R3-MYB型转录因子OfMYB21,它可以直接与OfTPS2基因的启动子结合并激活其表达,从而正调控桂花花朵中芳樟醇的合成;研究还发现能够与OfMYB21互作的另外两个转录因子OfMYC2和OfJAZ2/3,非常有趣的是OfMYC2与OfMYB21的相互作用进一步增强了靶基因OfTPS2的转录,而OfJAZ3与OfMYB21的相互作用则抑制了OfTPS2的表达(Lan et al.,2023)。在茶树中,MYB转录因子CsMYB83能够与萜类合成MEP途径的限速酶基因CsDXS的启动子结合,激活该基因表达,从而正向调控茶树萜类化合物的合成(Wang et al.,2022)。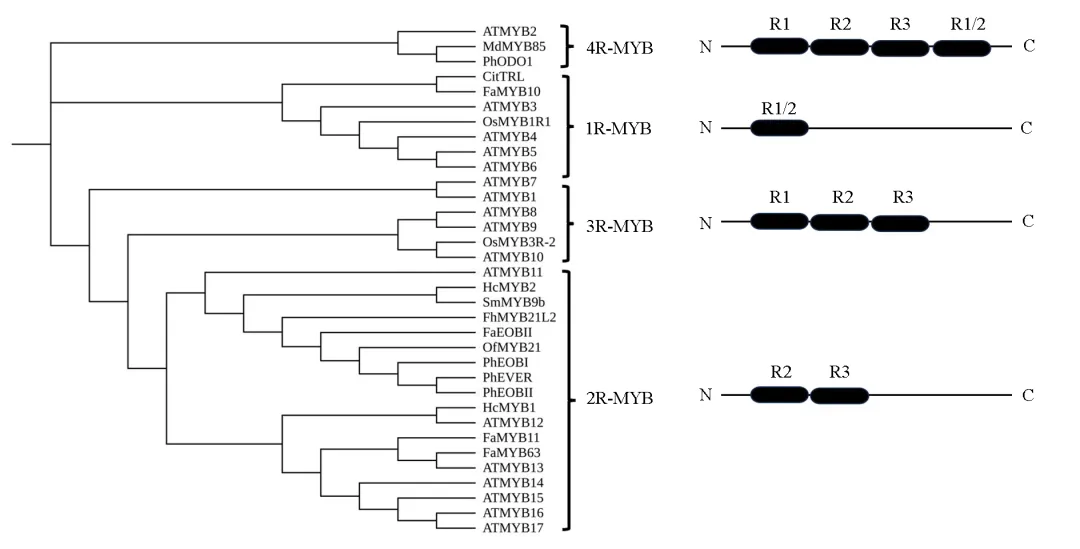
图1 植物MYB转录因子系统发育树
园艺植物芳香化合物的合成受温度、光照、水分、营养元素等环境因素影响。有研究表明MYB转录因子介导光信号对萜烯类芳香化合物合成的调控。当金鱼草(Antirrhinum majus)花朵暴露于蓝光时,激活蓝光受体AmCRY1,AmCRY1可与AmMYB24互作,并与罗勒烯合酶基因AmOCS的启动子结合,共同激活其表达,导致大量罗勒烯的排放(Han et al.,2022)。Yang等(2023)在‘西伯利亚’百合中发现一个受光照诱导表达的LiMYB108,其编码一个R2R3-MYB转录因子,研究发现LiMYB108可与萜烯合成酶基因LoTPS1的启动子结合,直接激活其表达,从而促进光照条件下β-罗勒烯和芳樟醇的合成(Yang et al.,2023)。COP1是一种E3泛素连接酶,在植物光形态建成中作为核心抑制因子,通过泛素—蛋白酶体系统降解光信号通路中的关键转录因子(如HY5),从而抑制光形态建成(Han et al.,2020)。Liu等(2023)在‘西伯利亚’百合中发现LoCOP1可以与LoMYB1和LoMYB3互作,并且在黑暗条件下LoCOP1与LoMYB1和LoMYB3的互作更强,从而负调控黑暗条件下罗勒烯、芳樟醇等花香化合物的合成。MYB转录因子除了参与调控观赏花卉萜类花香化合物的合成外,还参与一些药用植物的萜类活性成分的合成。例如,萜类物质是铁皮石斛(Dendrobium officinaleKimura et Migo)的重要药用成分。Lv等(2022)研究鉴定了调控(E)-β- 石竹烯合成的4个MYB转录因子(DoMYB26、DoMYB29、DoMYB31和DoMYB32),它们主要通过与铁皮石斛编码倍半萜合酶基因DoECS的启动子结合,调控DoECS的表达;其中,DoMYB26和DoMYB31正向调控DoECS的表达,而DoMYB29则负向调控DoECS的表达。丹参(Salvia miltiorrhiza Bunge)是一种具有重要药用价值的植物。在丹参中发现了一个R2R3-MYB转录因子SmMYB9b,属于2R-MYB型转录因子(图1),可以正调控丹参酮的合成;在过表达SmMYB9b的丹参毛状根中,丹参酮的含量比对照提高了2.2倍,其中萜类生物合成基因SmDXS2、SmDXR、SmGGPPS和SmKSL1的表达水平显著上调(Zhang et al.,2017)。图2 MYB转录因子调控园艺植物萜类芳香物质的合成
3.2 苯环/苯丙素类芳香物质的合成
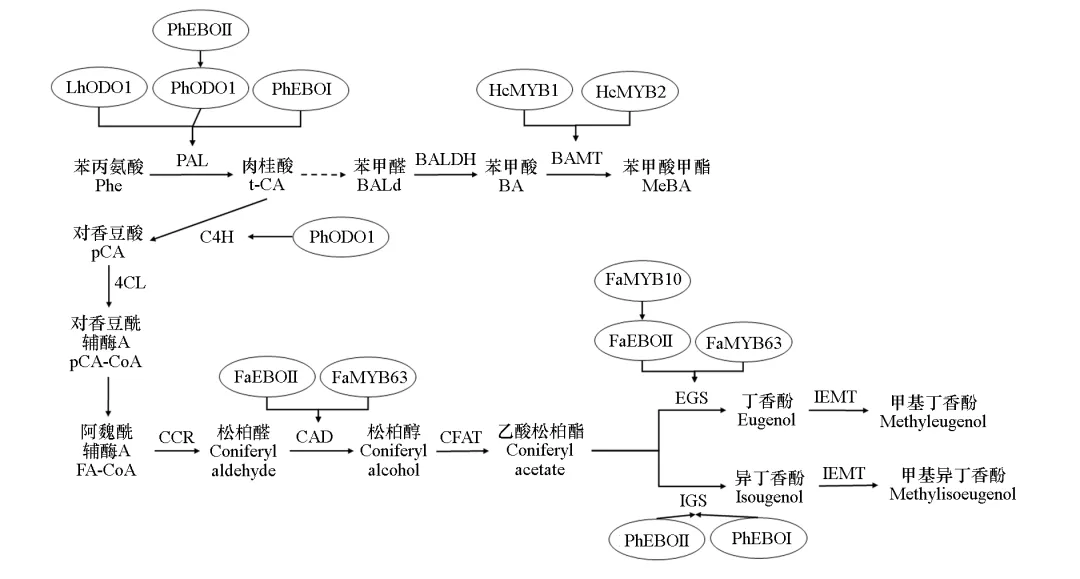
MYB转录因子主要通过调节苯丙素途径中结构基因的表达实现对园艺植物苯丙素类芳香化合物合成的调控(图3)。苯丙素类挥发性物质是矮牵牛(Petunia × hybrida)花香的重要组成成分,已有研究表明,MYB转录因子在调控矮牵牛苯丙素类花香化合物的合成代谢中起重要作用。在矮牵牛中鉴定了一个R2R3型MYB转录因子ODORANT1(PhODO1),PhODO1的表达具有昼夜节律性,其表达模式与花香的释放规律一致,在花香合成增加阶段PhODO1的表达水平上升,在花香释放减少阶段PhODO1的表达水平下降;在PhODO1干扰表达的转基因矮牵牛植株的花中,挥发性苯丙素类化合物的含量显著降低。研究表明,PhODO1可以与正调控莽草酸途径的EPSP(5–磷酸烯醇莽草酸–3–磷酸)合成酶基因的启动子结合,激活该基因的表达,从而影响相关前体物质的合成来影响苯丙素花香化合物合成(Verdonk et al.,2005)。进一步的研究表明,PhODO1是矮牵牛苯丙素类挥发性花香化合物合成的主调控因子,ChIP-seq结果显示它可以与莽草酸途径的DAHPS、EPSPS、CS和苯丙素途径的PAL、C4H、4CL、CCR、CAD和CFAT等基因的启动子结合,进而广泛调控矮牵牛苯丙素类花香化合物的合成和代谢(Boersma et al.,2022)。在百合中鉴定了一个与矮牵牛PhODO1相似的R2R3-MYB转录因子LhODO1。LhODO1在百合花被片中特异表达,将LhODO1转基因到矮牵牛中,能够上调莽草酸途径基因(EPSPS、CS、ADT1)和PAL基因的表达(Yoshida et al.,2018)。在矮牵牛中还发现了另外两个R2R3-MYB转录因子,分别命名为PhEOBI和PhEOBII,它们均属于2R-MYB型转录因子(图1),在调控矮牵牛苯丙素类花香化合物合成的过程中也发挥重要的作用。在沉默PhEOBII表达的矮牵牛花朵中,莽草酸和苯丙素合成途径相关基因CS、CM、PAL2、CFAT、IGS和BPBT的表达水平都下调,导致苯甲醛、苯乙醇、苯甲酸苯甲酯、丁香酚、异丁香酚等花香化合物的合成显著降低;进一步研究发现,PhEOBII可以直接与IGS和PAL基因的启动子结合,激活基因表达(Spitzer-Rimon et al.,2010)。研究还发现PhEOBII不仅在调控矮牵牛花香合成途径中发挥重要作用,而且在花朵从花蕾到开放的转变过程中也发挥关键的作用,在PhEOBII干扰表达的矮牵牛和烟草(Nicotiana attenuata)转基因植株中,花无法进入开放阶段,过早衰老;在干扰表达PhEOBI基因的矮牵牛转基因植株中,苯甲酸甲酯、苯甲酸乙酯、苯甲酸苯甲酯、丁香酚、异丁香酚、苯甲醇等苯丙素类花香化合物的释放量显著降低;进一步研究发现PhEOBI可以与IGS、PAL基因的启动子结合,激活这些基因的表达(Colquhoun et al.,2011)。此外,研究人员还发现上述3个MYB转录因子间也存在互相调控的关系,PhEOBII可以与PhODO1基因的启动子结合激活其表达,PhEOBI也正调控PhODO1基因的表达,在沉默PhEOBI或PhEOBII表达的矮牵牛植株中PhODO1的表达都显著下调,而在干扰表达PhODO1的矮牵牛转基因植株中PhEOBI基因的表达水平升高,这表明它们之间存在复杂的反馈调节机制(Spitzer-Rimon et al.,2012)。MYB转录因子不仅在园艺植物花香化合物的合成中起关键作用,而且在果实的苯丙素类芳香化合物的合成中也发挥重要作用(图3)。如在草莓(Fragaria × ananassa)中鉴定了与矮牵牛PhEOBII同源的MYB转录因子FaEOBII,它也属于2R-MYB型转录因子(图1),发现其调控草莓成熟果实(花托)中丁香酚的合成。沉默FaEOBII表达的草莓花托中,参与丁香酚合成的两个结构基因FaCAD和FaEGS2的表达水平显著下调,草莓果实中的丁香酚含量也显著下降,进一步研究发现FaEOBII可以激活FaCAD基因启动子的活性(Medina-Puche et al.,2015)。此外,研究人员还发现了另一个正调控草莓果实丁香酚合成的MYB转录因子FaMYB10,在干扰FaMYB10基因表达的草莓果实中FaEOBII的基因表达量显著下调,丁香酚的含量也显著降低,另外花青素的含量也显著降低,这说明FaMYB10不仅调控草莓果实芳香物质的合成,而且还调控花青素的合成(Medina-Puche et al.,2014)。Wang等(2022)还鉴定了一个参与草莓果实芳香成分丁香酚合成的R2R3-MYB转录因子FaMYB63,它可以直接与FaEGS1、FaEGS2和FaCAD1基因的启动子结合激活基因的表达,从而正调控丁香酚的合成。研究还发现,FaMYB63不仅参与调控丁香酚合成途径关键酶基因的表达,而且还可以与FaEOBII和FaMYB10的启动子结合激活它们的表达,从而从不同层面调控草莓果实丁香酚的生物合成(Wang et al.,2022)。图3 MYB转录因子调控园艺植物苯环/苯丙素类芳香物质的合成
MYB转录因子还可以同时调节萜类和苯环类芳香化合物的合成途径。在观赏植物姜花(Hedychium coronarium)中,HcMYB1和HcMYB2均属于2R-MYB型转录因子(图1),能与苯甲酸甲酯合成酶基因(HcBSMT2)的启动子结合,正调控苯甲酸甲酯的合成,此外HcMYB2还能与芳樟醇合成酶基因(HcTPS5)的启动子结合,正调控芳樟醇的合成;HcMYB1能够与生长素信号通路中的HcIAA4蛋白互作,并且HcIAA4可抑制HcMYB1对HcBSMT2启动子的激活,这揭示了在姜花中生长素通过Aux/IAA-MYB模块同时调控萜类和苯环类芳香化合物合成的机制(Ke et al.,2021)。在番茄(Solanum lycopersicum)中发现了一个MYB转录因子SlMYB75,也属于2R-MYB型转录因子(图1)。过表达SlMYB75可有效改善番茄果实的多种品质性状,SlMYB75过表达转基因植株中果实的酚类、类黄酮和可溶性固形物的总含量分别比对照的果实提高了2.6倍、4倍和1.2倍;SlMYB75过表达转基因番茄植株中果实的一些香气挥发物,如醛类、苯丙素类和萜类挥发物显著增加,其中一些萜类挥发物的含量比对照高出10倍以上,转录组分析表明,参与乙烯信号转导、苯丙氨酯和异戊烯类途径的基因在过量表达SlMYB75的转基因植株的果实中大幅上调,SlMYB75 通过转录调控涉及多个代谢途径的下游基因,被确定为果实品质属性的关键调控因子,这为改良具有更高感官和营养品质的果实开辟了新的途径(Jian et al.,2019)。MYB转录因子主要通过调控LOX和酰基转移酶基因的表达实现对园艺植物脂肪酸衍生物类芳香化合物合成的调控。研究报道,拟南芥AtMYB123可以通过抑制胚中脂肪酸的积累,调控脂质代谢(Wang et al.,2014)。草莓中的转录因子FaMYB11与拟南芥AtMYB123同源,属于2R-MYB型转录因子(图1),可通过直接与脂氧合酶基因(FaLOX5)的启动子结合,正调控酯类(如己酸己酯、3–甲基丁酸甲酯)和醛类(如(E)-2–辛烯醛)的合成(Lu et al.,2021)。苹果(Malus × domestica)果实中发现一个R2R3-MYB转录因子MdMYB85。过量表达MdMYB85的苹果果实中,酯类(如乙酸己酯、乙酸丁酯等)含量显著上升,JA信号通路相关基因(MdMYC2)、关键酯类合成基因(MdAAT1)及脂氧合酶(LOX)通路基因(MdLOX1a、MdADH、MdHPL)表达量上升;MdMYB85可以与MdMYC2和MdAAT1的启动子结合,从而增强其表达。同时,MdMYC2和MdMYB85蛋白之间的相互作用会增强MdMYB85与MdMYC2和MdAAT1启动子的结合活性,以及MdMYC2对MdMYB85和MdAAT1启动子的结合活性(Li et al.,2023)。4 MYB转录因子调控园艺植物芳香物质的储存和释放植物器官表皮蜡质或释香结构对芳香化合物的储存和释放有一定的调节功能。有研究表明,R2R3-MYB转录因子在园艺植物芳香化合物的储存和释放过程中也发挥重要作用。在矮牵牛中发现一个R2R3-MYB转录因子EVER通过调节花瓣表皮蜡质生物合成,影响矮牵牛花香挥发性化合物的释放;矮牵牛EVER在花瓣近轴侧表皮特异表达,沉默EVER,会导致花香化合物中低沸点挥发性化合物的排放增加,但不影响花香代谢途径上相关结构基因的表达和花香物质的积累(Skaliter et al.,2023)。留兰香(Mentha spicata)是一种具有商业价值的芳香植物,其精油主要包含柠檬烯和香芹烯等单萜类物质。在留兰香中发现了响应茉莉酸甲酯(MeJA)的R2R3-MYB转录因子SmMYB1,其负调控单萜化合物的合成;SmMYB1在留兰香叶表皮的盾状腺毛中表达量最高,抑制SmMYB1的表达导致单萜水平显著增加,而过表达SmMYB1则降低了单萜水平(Reddy et al.,2017)。MYB转录因子广泛参与园艺植物各种芳香化合物类型的合成代谢调控,在园艺植物芳香物质的合成调控中居于核心地位。已有的研究表明参与调控芳香化合物合成的MYB转录因子大多属于R2R3-MYB亚家族,少部分属于1R-MYB和4R-MYB家族,这表明在植物进化过程中,R2R3-MYB转录因子在调控芳香物质合成方面功能特化程度更高。芳香化合物作为园艺植物重要的次生代谢产物,是其香气品质的核心,直接决定了花卉、水果和蔬菜的商品价值和消费者接受度。同时,这些物质在植物与环境的相互作用中也扮演关键角色,既是吸引昆虫进行传粉的信号,也是抵御病虫害的化学防御武器。环境因素如光照、温度、水分和养分等会影响植物内部的代谢途径,影响芳香物质的合成。MYB作为调控芳香化合物合成的重要转录因子,它在行使功能时常整合光信号,对芳香物质的合成进行精细调控。在金鱼草中蓝光通过AmCRY1-AmMYB24模块,激活金鱼草AmOCS表达,促进罗勒烯释放(Han et al.,2022)。在百合中,光照可以影响光信号调控因子LoCOP1与LoMYB1/LoMYB3的互作强度,降低罗勒烯和芳樟醇在光照下的排放量(Liu et al.,2023)。而LiMYB108则受光诱导高表达,可直接激活LoTPS1表达,促进罗勒烯和芳樟醇的合成(Yang et al.,2023)。另外,非常有趣的是调控花香合成的MYB转录因子的基因表达常表现昼夜节律性,与花香的释放规律一致,也是植物适应环境的表现。例如,矮牵牛中的花香组分合成正调控因子PhODO1和花香释放调控因子EVER,它们的基因表达都呈现昼夜节律,表达高峰出现在夜里,这与它的授粉昆虫蛾类的活动规律是相适应的。在植物次生代谢调控中,MYB转录因子作为核心调控因子,在调控花色和花香合成代谢方面发挥重要的作用。在矮牵牛中,花青素于花发育早期合成并储存在液泡中,而挥发性化合物如异丁香酚和丁香酚则在花开放后大量合成,二者共同以4–香豆酰辅酶A(4-coumaroyl-CoA)为前体。当花香合成关键酶PhCCoAOMT1的表达受抑制后,其中间产物咖啡酸或其衍生物发生积累,这些积累的代谢物作为信号分子,特异性激活R2R3-MYB类转录因子PURPLE HAZE和DEEP PURPLE,进而促使MBW复合物形成,上调花青素合成相关基因的表达,使得矮牵牛花瓣变紫,这说明矮牵牛的花色和花香合成过程中存在反馈调节的机制(Shaipulah et al.,2016)。在月季中的R2R3-MYB转录因子RcMYB1可以直接调控花色和花香的合成。它能够与bHLH(RcbHLH42或RcEGL1)及WD40(RcTTG1)蛋白形成MBW复合物,直接激活花青素晚期合成基因(RcDFR)以促进色素积累,还能直接结合花香合成基因如RcEGS1(丁香酚合成)和RcNUDX1(香叶醇合成)的启动子,直接上调丁香酚和香叶醇合成相关基因的表达水平,促进花香芳香化合物的合成。这表明MYB转录因子在植物应对发育需求与环境信号和实现生态适应中发挥着至关重要的作用,也为作物多性状协同育种提供了重要的理论依据。研究挥发性芳香物质必须置于植物整体代谢与调控网络的背景下,才能全面理解其合成途径、调控机制及生物学功能。当前该领域研究主要围绕两个层次展开:其一,应用外源诱导因子(如激素、逆境信号)结合多组学技术(转录组、蛋白组、代谢组)筛选和验证与芳香物质积累相关的MYB转录因子;其二,系统解析MYB在不同物种、组织及发育阶段的表达模式,揭示其调控芳香合成的分子机制,包括与其他转录因子或功能蛋白的互作关系。然而,MYB在芳香化合物生物合成中的调控机制仍存在若干关键问题亟待突破。首先,芳香代谢网络高度复杂,MYB在其中所参与的转录调控网络,尤其是与其他核心转录因子(如bHLH、WRKY等)或蛋白复合体的协同互作机制,目前研究仍较为零散,缺乏系统性的整合分析。其次,尽管芳香物质在植物应对光温等环境胁迫中起到重要的保护作用,MYB转录因子在环境信号应答与芳香合成交叉调控中的功能研究仍显不足,其介导的逆境响应与香气合成之间的协调机制尚不明确。未来研究可重点关注以下方向:深入解析MYB参与的复合调控网络,特别是MBW复合体(MYB–bHLH–WD40)在芳香代谢中的组成方式、动态互作与功能协同机制;系统整合茉莉酸、光周期等环境信号,以揭示MYB在时空维度上的表达特性及其在香气合成与抗逆反应中的双重调控功能;借鉴MYB在干旱、盐胁迫等非生物胁迫中的已有调控网络,利用基因编辑、转基因及多组学联合分析策略,精准平衡香气品质与抗逆性状,为培育优质高抗型园艺作物提供新基因资源与育种策略。该研究以北京林业大学为第一和通信单位。陈赟为该综述的第一作者。包菲副教授为该综述的通信作者。

第一作者 陈赟
北京林业大学园林学院包菲副教授团队围绕传统名花梅花的低温下开放和具独特花香两大重要观赏性状开展研究。在梅花花香研究方向,评价梅花种质不同香型,解析梅花特征花香化合物的合成代谢途径和调控网络;在梅花抗寒研究方向,构建梅花品种抗寒力评价体系,鉴定影响梅花抗寒的重要基因,解析梅花抗寒信号通路。先后主持国家自然科学基金青年项目、面上项目、北京市自然科学基金青年项目等科研项目6项,以第一作者和通讯作者在New Phytologist、Horticulture Research和Frontiers in Plant Science等期刊发表论文12篇。
阅读推荐:
园艺学报花香专辑|南京林大桂花种质资源创新与利用团队:花香的生物功能及其合成机制研究进展
园艺学报花香专辑|中国农业大学洪波教授团队:菊花花香突变体香气成分鉴定与萜烯合酶基因表达特性分析
园艺学报花香专辑|广东农科院朱根发/杨凤玺团队:腋唇兰花香成分鉴定和关键调控基因挖掘
园艺学报花香专辑|北京林业大学孙明教授团队:‘梨香’菊花香成分鉴定及香气特征分析
园艺学报花香专辑|云南农科院月季创新团队:月季花香物质合成基因及其演化机制研究进展
园艺学报花香专辑|河南科技大学农学院侯小改教授团队:牡丹花香的生物合成及调控研究进展
园艺学报花香专辑|华南农业大学园艺学院范燕萍教授团队:观赏植物花香性状形成及调控机制研究进展
园艺学报花香专辑|北京林业大学孙丽丹教授团队:梅花花香研究进展