PBJ | 河南农业大学张会勇课题组解析tRNA硫醇化蛋白ZmCTU2在玉米耐高温胁迫中的作用机制
- 2026-02-10 22:27:31






1. ZmCTU2 作为应激颗粒组分正向调控玉米耐热性
尽管tRNA硫醇化修饰在耐热性中的作用已得到证实,但其在玉米中的功能仍不明确。通过比较转录组分析,研究者鉴定到一个热响应基因GRMZM2G362306,该基因编码细胞质tRNA硫修饰蛋白2,命名为ZmCTU2。RT-qPCR结果独立验证了这一诱导表达模式(图1A)。已有研究将261份玉米自交系在高温条件下的结实率划分为9个等级,等级越高表明耐热性越强(Gao et al. 2019)。本研究从中选取46份结实率等级为1-9级的材料,检测其ZmCTU2表达水平。分析结果显示,热胁迫(HS)条件下ZmCTU2表达量与结实率呈显著正相关(图1B),表明ZmCTU2可能参与玉米耐热性调控。
通过在玉米叶肉原生质体中表达35S:ZmCTU2-YFP载体,分析ZmCTU2的亚细胞定位。结果观察到两种不同的定位模式:模式C1中,ZmCTU2-YFP荧光弥散分布于细胞质中,偶见点状聚集体(图1C);模式C2中,ZmCTU2-YFP荧光仅局限于点状聚集体(图1C)。利用RFP标记的核标记物(Nu-RFP)和应激颗粒(SG)标记物(AtUBP1B-RFP;SG-RFP)进行共定位分析发现,弥散分布的ZmCTU2与细胞质RFP共定位,而点状ZmCTU2聚集体与SG标记物共定位,且两种定位模式均不与核标记物重叠(图1C)。上述结果表明,ZmCTU2定位于细胞质或SG中(图1C)。正常条件(NC)下,98.3%的细胞表现为C1模式(图1D);而热胁迫处理后,87.1%的细胞呈现C2模式(图1D),说明热胁迫可促进ZmCTU2募集到SG中。
为验证ZmCTU2的功能,研究者对热胁迫处理的ZmCTU2-YFP或YFP对照表达原生质体进行免疫沉淀-液相色谱/质谱联用(IP-LC/MS)分析。定量质谱鉴定到数百种在ZmCTU2-YFP沉淀产物中特异性富集的蛋白(倍数变化>2)。基因GO富集分析显示,这些蛋白显著富集于SG相关功能,包括核糖体组分、RNA结合蛋白、翻译起始因子和热休克蛋白结合等(图1E),证明ZmCTU2在热胁迫下作为SG组分发挥作用。此外,以ZmCTU2全长为诱饵进行酵母双杂交(Y2H)筛选,获得77个阳性克隆,其中多个克隆编码已知的SG相关组分,包括核糖体亚基和RNA结合蛋白。选取ZmRPS10(40S核糖体蛋白)和ZmIF3m(翻译起始因子)进行验证,将GAL4-AD-ZmRPS10/ZmIF3m与GAL4-BD-ZmCTU2共表达后,酵母可在四缺培养基(QDO,SD/-Ade/-His/-Leu/-Trp)上生长,证实ZmCTU2与ZmRPS10或ZmIF3m存在直接相互作用(图1F)。双分子荧光互补(BiFC)实验进一步在植物细胞中验证了这些相互作用:正常条件下观察到弥散的细胞质信号及少量焦点,而热胁迫诱导ZmCTU2-ZmRPS10和ZmCTU2-ZmIF3m复合物特异性凝聚为细胞质焦点(图1G)。综上,这些数据证实ZmCTU2是玉米热胁迫响应过程中的核心SG组分。
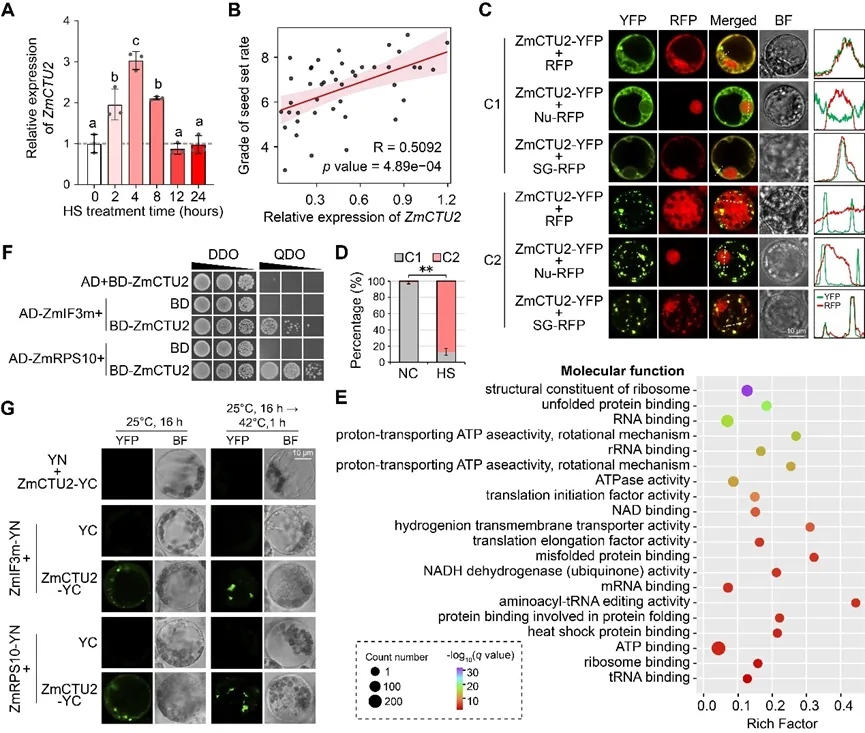
图1. ZmCTU2作为应激颗粒组分正向调控玉米耐热性


2. ZmCTU2过表达增强玉米耐热性
为探究ZmCTU2在玉米耐热性中的功能,研究者在B104自交系背景下,利用玉米泛素(Ubi)启动子驱动ZmCTU2全长CDS过表达,获得转基因玉米植株(图2A)。通过PCR初步筛选鉴定阳性转基因株系(图2B),随后通过RT-qPCR和免疫印迹(Immunoblotting)验证了ZmCTU2的转录本和蛋白积累水平(图2C)。选取两个独立的高表达株系(OEZmCTU#2和OEZmCTU#4)及一个阴性对照株系(NL)进行后续表型鉴定(图2C)。在循环热胁迫(白天43℃/16h,夜间39℃/8h;处理6天+恢复7天)条件下,野生型B104和NL幼苗的死亡率约为60%(图2D、2E);而ZmCTU2过表达株系的存活率显著提高(约80%),且鲜重增加(图2D-2F)。这些结果表明,ZmCTU2过表达可显著增强玉米幼苗的耐热性。
在中国黄淮海地区,夏季高温期(6-8月)恰逢玉米开花授粉期—这是玉米对热胁迫最敏感的发育阶段。为评估ZmCTU2在生殖期耐热性中的作用,研究者通过跨地点分期播种,确保玉米在该关键时期同步遭遇热胁迫。2021年11月在三亚播种的材料,开花期为2022年2月22日-3月1日,期间温度适宜(最高温=29℃)(图2G),各基因型材料的产量和百粒重无显著差异(图2H-2J),株高、穗位高、穗长、穗粗、穗行数和行粒数等农艺性状也无明显差异。相比之下,2022年5-6月在郑州播种的材料,开花期遭遇连续高温(>35℃)(图2G),所有基因型材料的产量均较三亚对照显著下降:5月播种材料的穗产量降幅分别为B104(65%)、NL(71%)、OEZmCTU#2(53%)和OEZmCTU#4(56%),百粒重降幅为26%-28%(图2H-2J);6月播种材料的产量降幅达B104(72%)、NL(77%)、OEZmCTU#2(66%)和OEZmCTU#4(67%),百粒重降幅为41%-43%(图2H-2J)。关键的是,热胁迫条件下,尽管各基因型材料的百粒重受影响程度相当,但ZmCTU2过表达株系的穗产量始终高于B104和转基因阴性株系(图2I、2J),表明ZmCTU2介导的产量提升主要源于结实率的提高而非籽粒大小的增加。
图2. 过表达ZmCTU2增强玉米苗期和开花期耐热性


3. ZmCTU2功能缺失影响玉米种子发育
为进一步验证ZmCTU2在玉米耐热性中的作用,研究者从玉米EMS突变体库(http://www.elabcaas.cn/memd/)中筛选到一个突变体株系(EMS4-190f08;zmctu2#1)。该株系的第4外显子存在提前终止密码子,导致ZmCTU2蛋白C端197个氨基酸缺失(图3A)。对ZmCTU2#1+/-自交后代进行基因分型,始终未获得ZmCTU2#1-/-纯合突变体。ZmCTU2#1+/+(♀)×ZmCTU2#1+/-(♂)杂交后代的基因型比例为ZmCTU2#1+/+∶ZmCTU2#1+/-∶ZmCTU2#1-/-≈1∶1∶0(图3B);ZmCTU2#1+/-(♀)×ZmCTU2#1+/+(♂)杂交组合也得到类似结果(图3B)。KI-I2和TTC染色结果显示,ZmCTU2#1+/-植株的花粉发育和活力正常(图3C),排除了ZmCTU2#1-/-配子发生缺陷的可能性。关键的是,ZmCTU2#1+/-自交穗上出现大量发育异常的籽粒,其长度、宽度和厚度均显著减小(图3B)。这些缺陷籽粒无法萌发(图3D),极少数萌发的幼苗表现出严重的生长迟缓,最终死亡。基因分型证实,这些缺陷籽粒均为ZmCTU2#1-/-基因型(图3D)。上述结果表明,ZmCTU2对玉米种子发育和萌发至关重要。
为进一步验证这一发现,研究者鉴定到另一个突变体株系(EMS3-038762;zmctu2#2),其第4外显子同样存在提前终止密码子,导致ZmCTU2蛋白196个氨基酸缺失。与zmctu2#1表型一致,数百株ZmCTU2#2+/-自交后代中未筛选到ZmCTU2#2-/-纯合突变体,且ZmCTU2#2+/-自交穗上出现多个发育缺陷、尺寸显著减小的籽粒。为补充遗传证据,研究者构建了靶向ZmCTU2第2外显子的CRISPR-Cas9敲除株系。从16株T0代杂合突变体中,筛选到一个在CDS第331位插入T的移码突变体ZmCTU2#Cas+/-。值得注意的是,ZmCTU2#Cas+/-自交后代中未获得纯合突变体,且穗上出现尺寸显著减小的异常籽粒。综上,这些结果证实ZmCTU2功能缺失会损害玉米种子发育。
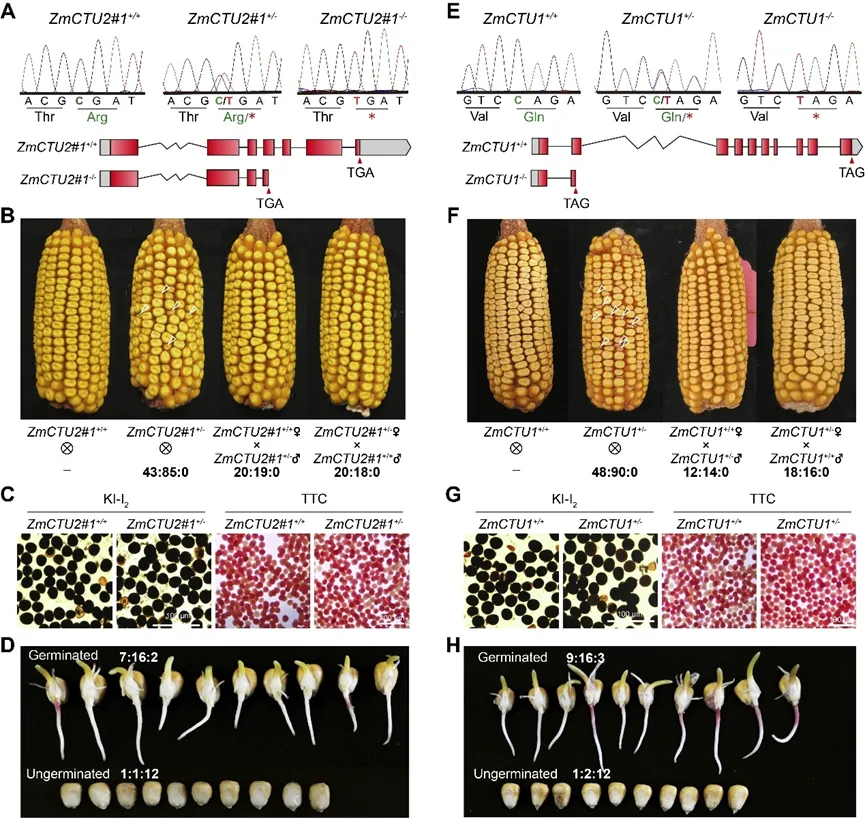
图3. ZmCTU2和ZmCTU1功能突变影响玉米种子发育

4. 热胁迫下ZmCTU2募集ZmCTU1进入应激颗粒并参与玉米tRNA硫修饰
在真核生物中,CTU1-CTU2异源二聚体以Urm1为硫载体催化tRNA硫修饰。以拟南芥ROL5/AtCTU1和AtURM11为查询序列,研究者鉴定到它们在玉米中的同源基因:GRMZM2G402242(命名为ZmCTU1)和GRMZM2G179689(ZmURM1)。重要的是,IP-MS和Y2H筛选结果均显示ZmCTU1是ZmCTU2的高置信度互作蛋白。酵母双杂交实验证实,ZmCTU2可直接与ZmCTU1相互作用,但不与ZmURM1互作,而ZmCTU1可结合。
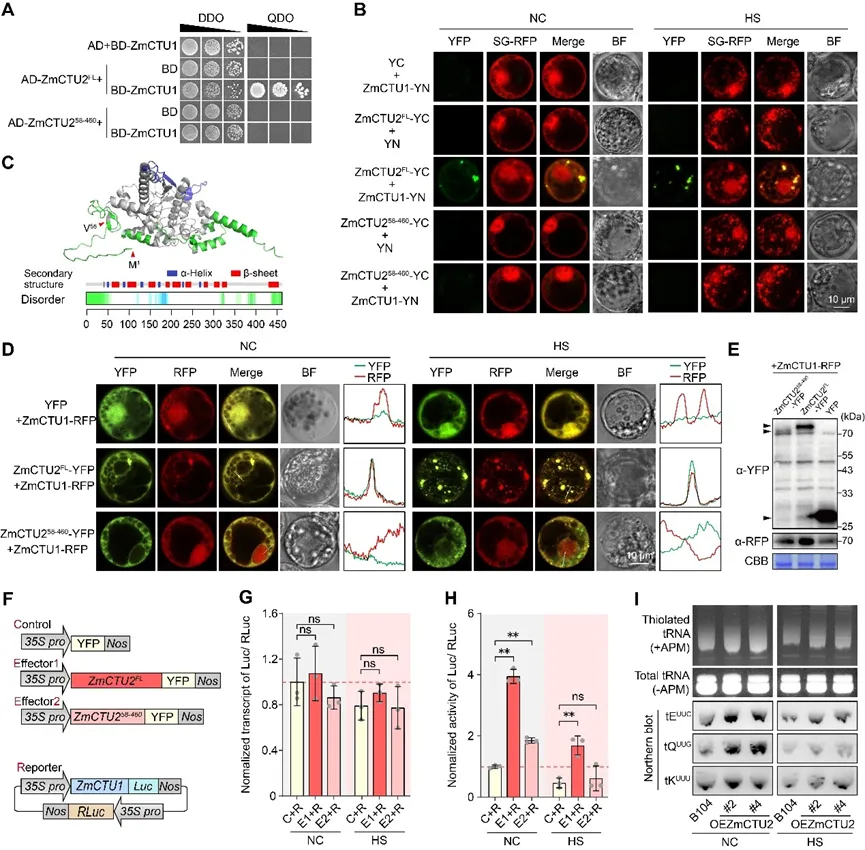
图4. 热胁迫下ZmCTU2募集ZmCTU1进入应激颗粒并参与玉米tRNA硫修饰

ZmURM1(图4A)。BiFC实验进一步在玉米细胞中验证了ZmCTU2与ZmCTU1的相互作用:ZmCTU2-YC与ZmCTU1-YN共转化的原生质体中可检测到YFP荧光,而空载体对照中无荧光信号(图4B)。此外,ZmCTU1与ZmCTU2的互作信号与SG-RFP标记物共定位,热激处理后形成明显的YFP标记颗粒,且与SG重叠(图4B)。与ZmCTU2类似,ZmCTU1具有相似的组织特异性表达模式,且受热胁迫诱导表达。这些结果表明,ZmCTU1和ZmCTU2可能在同一分子通路中发挥相似的生物学功能。为验证这一推测,研究者筛选到一个玉米ZmCTU1突变体(EMS4-132af9;zmctu1),其第2外显子存在提前终止密码子(图3E)。与zmctu2突变体类似,未从zmctu1杂合自交后代中获得纯合突变体,且杂合自交穗上出现大量发育停滞的异常籽粒(图3F)。正反交和花粉活力实验表明,配子体发育未受影响(图3F-G)。萌发实验显示,异常籽粒完全无法萌发(图3H),极少数萌发的幼苗表现出严重的生长迟缓并最终死亡。基因分型进一步证实,这些缺陷籽粒均为ZmCTU1-/-基因型(图3H)。上述结果表明,ZmCTU2-ZmCTU1复合物中任一组分功能受损都会破坏玉米种子发育和萌发。
二级和三级结构预测显示,ZmCTU2N端1-57位氨基酸形成无序区(图4C)。截短分析进一步证实,该N端无序区对ZmCTU1-ZmCTU2异源二聚体的形成至关重要:缺失1-57位氨基酸(ZmCTU258-460)后,ZmCTU2与ZmCTU1在酵母和玉米细胞中的相互作用均完全消失(图4A、4B)。随后,研究者探究了ZmCTU2的无序区对ZmCTU2与ZmCTU1共定位动态的影响。与YFP空载体共表达时,ZmCTU1-RFP在细胞中呈弥散分布,热胁迫后形成少量点状结构,但这些点状结构的数量和密度均低于ZmCTU2FL-YFP形成的结构(图4D)。相比之下,与ZmCTU2FL-YFP共表达时,正常条件下两种蛋白弥散分布于细胞质中,偶见少量点状结构;而热激处理后,YFP和ZmCTU1-RFP信号完全共定位于SG相关焦点(图4D)。值得注意的是,缺失N端无序区的ZmCTU258-460-YFP在热胁迫条件下显著削弱了ZmCTU2和ZmCTU1的SG定位(图4D),且ZmCTU1-RFP与ZmCTU258-460-YFP的共定位程度显著低于其与ZmCTU2FL-YFP的共定位程度(图4D)。综上,这些结果表明,热胁迫下ZmCTU2通过物理相互作用募集ZmCTU1进入SG,且ZmCTU2的N端无序区对这一过程不可或缺。此外,ZmURM1-RFP在所有条件下均呈弥散分布于细胞中,不形成点状结构,且其定位不受ZmCTU1或ZmCTU2共表达的影响,表明ZmURM1不参与SG组成。
为探究ZmCTU2介导的SG定位对ZmCTU1蛋白稳定性的影响,研究者将ZmCTU1-RFP分别与ZmCTU2FL-YFP、ZmCTU258-460-YFP或YFP对照共表达于玉米原生质体中。25℃培养16h后进行热胁迫处理,收集细胞进行免疫印迹分析。结果显示,ZmCTU2FL-YFP共表达组的ZmCTU1-RFP信号强度显著高于ZmCTU258-460-YFP或YFP对照组(图4E)。双荧光素酶报告基因实验进一步验证了这一结果:构建ZmCTU1-LUC表达载体,与ZmCTU2FL或ZmCTU258-460编码载体共转化(图4F)。正常和热胁迫条件下,ZmCTU258-460均未改变ZmCTU1-LUC的转录本丰度(图4G),表明二者在转录水平上相互独立。热胁迫显著降低了所有实验组的相对LUC活性,这与热胁迫对蛋白稳态的干扰一致(图4H)。值得注意的是,与ZmCTU2FL共表达可在正常和热胁迫条件下均显著增强LUC活性,而ZmCTU258-460共表达组的增强效果显著弱于ZmCTU2FL组(图4H)。这些结果证实,ZmCTU2可稳定ZmCTU1蛋白水平,且其N端无序区对这一调控功能至关重要。
由于tRNA提取需要大量植物材料,且无法获得ZmCTU2和ZmCTU1纯合突变体,研究者无法直接评估功能缺失突变体对tRNA硫修饰的影响。然而,定量分析显示,与野生型对照相比,ZmCTU2+/-和ZmCTU1+/-植株中ZmCTU2和ZmCTU1的转录本水平均降低了2倍以上。对这些基因型材料的tRNA进行APM-PAGE分析发现,tRNA硫修饰水平显著降低,表明ZmCTU2或ZmCTU1的部分功能缺失会损害这一转录后修饰,这与已有报道一致。正常条件下,ZmCTU2过表达株系的tRNA硫修饰水平高于野生型B104(图4I);热胁迫降低了两种基因型的tRNA硫修饰水平,但过表达株系的修饰水平仍显著高于B104(图4I)。利用tKUUU、tEUUC和tQUUG特异性探针进行Northernblot分析,进一步证实ZmCTU2过表达植株的tRNA硫修饰增强(图4I)。综上,这些数据表明,ZmCTU2过表达可缓解热胁迫诱导的tRNA硫修饰抑制,并在正常和热胁迫条件下均增强玉米中的这一修饰过程。

5. 热胁迫下ZmCTU2募集ZmPOX进入应激颗粒以维持ROS稳态
通过Y2H文库筛选ZmCTU2的互作蛋白,研究者在已知SG组分之外还鉴定到多个过氧化氢清除酶(表S2)。选取过氧化物酶ZmPOX(Zm00001eb195210)进行验证,酵母双杂交实验证实ZmCTU2与ZmPOX存在直接相互作用(图5A)。利用BiFC实验在体内进一步证实了这一互作:正常条件下,ZmCTU2-ZmPOX组合的YFP信号未检测到;而热胁迫后,可观察到明显的细胞质焦点,且这些YFP信号与SG-RFP信号重叠(图5B)。为观察亚细胞动态,研究者将ZmPOX-RFP与ZmCTU2-YFP或对照YFP共转化玉米原生质体。正常条件下,ZmPOX-RFP主要弥散分布于细胞质中,偶见团块状聚集体;而热胁迫触发ZmPOX-RFP与ZmCTU2-YFP标记的SG强烈共定位,且对照YFP组未出现此类SG募集现象(图5C)。这些结果表明,ZmCTU2可直接与过氧化物酶相互作用,并在热胁迫下介导其募集到SG中。
为探究ZmCTU2介导的SG定位对ZmPOX蛋白稳定性的影响,将ZmPOX-RFP分别与ZmCTU2-YFP或YFP对照载体共转染玉米原生质体。25℃培养16h后进行热胁迫处理,收集细胞进行免疫印迹分析。结果显示,ZmCTU2-YFP共表达样品的ZmPOX-RFP信号强度明显高于YFP对照组(图5D)。双荧光素酶报告基因实验进一步验证了这一结果:将ZmPOX-LUC报告载体与ZmCTU2-YFP效应载体或YFP对照载体共转化玉米原生质体(图5E)。定量分析显示,正常和热胁迫条件下,ZmCTU2共表达均未显著改变ZmPOX-LUC的转录本水平(图5F)。关键的是,ZmCTU2共表达显著提高了LUC活性,尤其在热胁迫条件下(图5G)。尽管热胁迫降低了所有组的相对LUC活性,但ZmCTU2共表达组的降幅(较正常条件下降53%)低于对照组(较正常条件下降69%)(图5G)。这些结果表明,热胁迫下ZmCTU2可稳定ZmPOX蛋白水平。
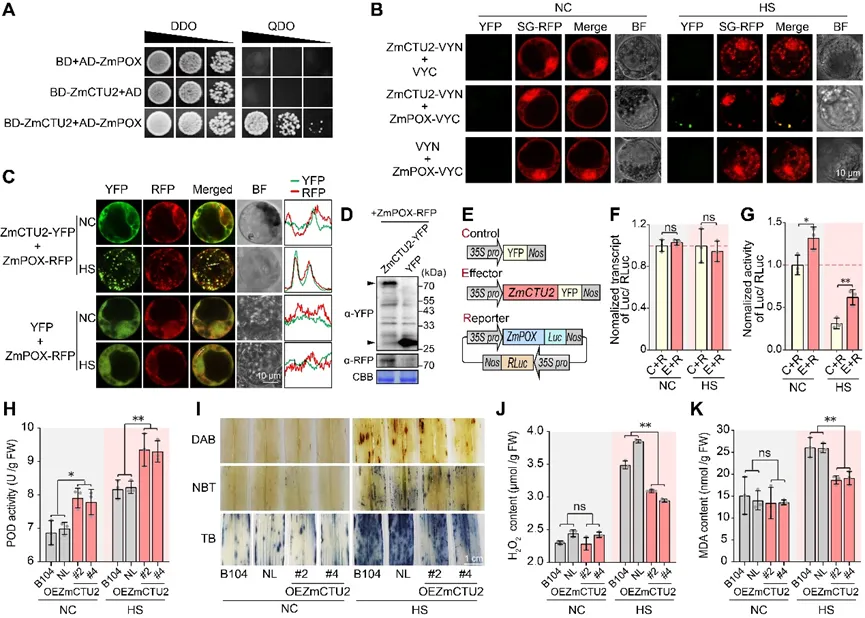
图5. 热胁迫下ZmCTU2募集ZmPOX进入应激颗粒以维持ROS稳态


6. ZmCTU2过量积累增强热胁迫下的蛋白质组重编程
为进一步探究ZmCTU2介导耐热性的分子机制,研究者对野生型B104和ZmCTU2过表达株系进行了比较蛋白质组学分析。三叶期幼苗在正常温度(NC;25℃培养12天)下生长后,进行热胁迫处理(HS;43℃处理8h)。利用串联质量标签(TMT)定量蛋白质组学技术,共鉴定到9422个高置信度蛋白,以|倍数变化|≥1.2且P<0.05为标准筛选差异表达蛋白(DEP)。结果显示,热胁迫下ZmCTU2过表达株系的蛋白质组重编程比野生型B104更显著:过表达株系中有1196个蛋白(12.7%)上调、2041个蛋白(21.7%)下调,而B104中分别有917个蛋白(9.7%)上调、1875个蛋白(19.9%)下调(图6A)。比较分析发现,ZmCTU2过表达株系中777个上调蛋白在B104热胁迫处理后表达无显著变化,这些蛋白构成了一类独特的“响应增强型蛋白”(图6B)。对这些响应增强型蛋白进行GO富集分析,发现其显著富集于翻译、翻译忠实性正向调控、蛋白折叠、SG组装和核糖体大亚基组装等关键生物学过程(图6C)。这些结果表明,ZmCTU2过表达可增强热胁迫诱导的蛋白质组重编程,尤其是强化翻译相关通路和蛋白质质量控制机制的响应性。这种协同调控可能有助于ZmCTU2过表达植株更好地适应热胁迫。
图6. ZmCTU2过量积累增强热胁迫下的蛋白质组重编程



References:
l Xu, Y., C. Chu, and S. Yao. 2021. “The Impact of High- Temperature Stress on Rice: Challenges and Solutions.” Crop Journal 9: 963–976.
l Sprague, S. A., T. M. Tamang, T. Steiner, et al. 2022. “Redox- Engineering Enhances Maize Thermotolerance and Grain Yield in the Field.” Plant Biotechnology Journal 20: 1819–1832.
l Casaretto, J. A., A. El- Kereamy, B. Zeng, et al. 2016. “Expression of OsMYB55 in Maize Activates Stress- Responsive Genes and Enhances Heat and Drought Tolerance.” BMC Genomics 17: 312.
l Doğru, A. 2021. “Effects of Heat Stress on Photosystem II Activity and Antioxidant Enzymes in Two Maize Cultivars.” Planta 253: 85.
l Janni, M., M. Gullì, E. Maestri, et al. 2020. “Molecular and Genetic Bases of Heat Stress Responses in Crop Plants and Breeding for Increased Resilience and Productivity.” Journal of Experimental Botany 71: 3780–3802.
l Yang, H., Y. Zhao, N. Chen, et al. 2021. “A New Adenylyl Cyclase, Putative Disease- Resistance RPP13- Like Protein 3, Participates in Abscisic Acid- Mediated Resistance to Heat Stress in Maize.” Journal of Experimental Botany 72: 283–301.
l Zhao, Y., H. Du, Y. Wang, et al. 2021. “The Calcium- Dependent Protein Kinase ZmCDPK7 Functions in Heat- Stress Tolerance in Maize (Zea mays L.).” Journal of Integrative Plant Biology 63: 510–527.
l Begcy, K., T. Nosenko, L. Z. Zhou, L. Fragner, W. Weckwerth, and T. Dresselhaus. 2019. “Male Sterility in Maize After Transient Heat Stress During the Tetrad Stage of Pollen Development.” Plant Physiology 181: 683–700.
l Gao, J., S. Wang, Z. Zhou, et al. 2019. “Linkage Mapping and Genome- Wide Association Reveal Candidate Genes Conferring Thermotolerance of Seed- Set in Maize.” Journal of Experimental Botany 70: 4849–4864.
l Jagadish, S. V. K. 2020. “Heat Stress During Flowering in Cereals— Effects and Adaptation Strategies.” New Phytologist 226: 1567–1572.
l Lizaso, J. I., M. Ruiz- Ramos, L. Rodríguez, et al. 2018. “Impact of High Temperatures in Maize: Phenology and Yield Components.” Field Crops Research 216: 129–140.
l Cicchino, M., J. I. R. Edreira, M. Uribelarrea, and M. E. Otegui. 2010. “Heat Stress in Field- Grown Maize: Response of Physiological Determinants of Grain Yield.” Crop Science 50: 1438–1448.
l Edreira, J. I. R., E. B. Carpici, D. Sammarro, and M. E. Otegui. 2011. “Heat Stress Effects Around Flowering on Kernel Set of Temperate and Tropical Maize Hybrids.” Field Crops Research 123: 62–73.
l Niu, S., X. Du, D. Wei, et al. 2021. “Heat Stress After Pollination Reduces Kernel Number in Maize by Insufficient Assimilates.” Frontiers in Genetics 12: 728166.
l Lobell, D. B., and C. B. Field. 2007. “Global Scale Climate–Crop Yield Relationships and the Impacts of Recent Warming.” Environmental Research Letters 2: 014002.
l Zhu, S., J. Gu, J. Yao, et al. 2022. “Liquid- Liquid Phase Separation of RBGD2/4 Is Required for Heat Stress Resistance in Arabidopsis.” Developmental Cell 57: 583–597.
l Chantarachot, T., and J. Bailey- Serres. 2018. “Polysomes, Stress Granules, and Processing Bodies: A Dynamic Triumvirate Controlling Cytoplasmic mRNA Fate and Function.” Plant Physiology 176: 254–269.
l Kosmacz, M., M. Gorka, S. Schmidt, et al. 2019. “Protein and Metabolite Composition of Arabidopsis Stress Granules.” New Phytologist 222: 1420–1433.
l Protter, D. S. W., and R. Parker. 2016. “Principles and Properties of Stress Granules.” Trends in Cell Biology 26: 668–679.
l Maruri- López, I., N. E. Figueroa, I. E. Hernández- Sánchez, and M. Chodasiewicz. 2021. “Plant Stress Granules: Trends and Beyond.” Frontiers in Plant Science 12: 722643.
l Ruiz- Solaní, N., J. Salguero- Linares, L. Armengot, et al. 2023. “Arabidopsis Metacaspase MC1 Localizes in Stress Granules, Clears Protein Aggregates, and Delays Senescence.” Plant Cell 35: 3325–3344.
l Wen, J., Z. Qin, L. Sun, et al. 2023. “Alternative Splicing of TaHSFA6e Modulates Heat Shock Protein- Mediated Translational Regulation in Response to Heat Stress in Wheat.” New Phytologist 239: 2235–2247.

为了能更有效地帮助广大的科研工作者获取相关信息,植物生物技术Pbj特建立微信群,PlantBiotechnologyJournal投稿以及文献相关问题、公众号发布内容及公众号投稿问题都会集中在群内进行解答,同时鼓励在群内交流学术、碰撞思维。为了保证群内良好的讨论环境,请先添加小编微信,扫描二维码添加,之后我们会及时邀请您进群。小提示:添加小编微信时及进群后请务必备注学校或单位+姓名,PI在结尾注明,我们会邀请您进入PI群。


