3.1. 植物生长及Cd在叶片和根中的积累与分布
生长响应: 低浓度Cd(10 μmol/kg)促进生长,高浓度(50, 100, 250 μmol/kg)则显著抑制。
浓度依赖: 根和叶中的Cd含量随处理浓度的升高而增加,呈浓度依赖性。
根部富集: 根系中的Cd含量显著高于叶片,且转运系数极低(0.03至0.44)。
与对照组相比,不同浓度的Cd处理显著影响了幼苗的地上部长度、根长及单株生物量。在10 μmol/kg Cd处理下,地上部长度、根长和单株生物量均较对照组有显著增加(p < 0.05)。然而,在50、100和250 μmol/kg Cd处理下,地上部长度分别比对照组下降了2.51%、11.98%和22.47%;根长分别下降了2.82%、3.53%和5.48%;单株生物量则分别下降了8.68%、11.10%和17.60%。Cd处理后,红豆草根和叶组织中的Cd含量均呈浓度依赖性增加。具体而言,叶片中的Cd含量范围为0.02至11.50 mg/kg,而根中的含量范围为0.68至28.0 mg/kg。根中Cd含量的增幅显著高于叶片,表明Cd被有效地滞留在根组织中。10、50、100和250 μmol/kg Cd处理的转运系数分别为0.03、0.14、0.39和0.44 (Fig. 1 A, B, C)。
图1. Cd处理下红豆草的生理分析。 (A) Cd胁迫对根和地上部长度的影响。(B) Cd胁迫对单株鲜重的影响。(C) 地上部和根中的Cd积累。条形图上方的不同字母表示处理间存在统计学显著差异(Tukey's HSD检验, P < 0.05)。误差棒代表±SE(n = 5)。
3.2. Cd处理下红豆草差异表达基因(DEGs)的分析
测序质控: 获得高质量转录组数据,PCA分析表明处理是基因表达差异的主要驱动因素。
差异基因: 在50 μmol/kg和250 μmol/kg Cd²⁺处理下,分别鉴定出大量上调和下调的基因。
功能富集: GO富集分析指向金属离子转运和液泡等关键过程;KEGG富集分析揭示了谷胱甘肽代谢、MAPK信号通路等重要途径。
共获得60.12 Gb的清洁数据,每个样品的产出不低于6.06 Gb,所有样品的Q30碱基百分比均超过96.52%。主成分分析(PCA)显示,样品按处理条件清晰分离,生物学重复间相关性高,表明处理是驱动样品间基因表达差异的主要因素。在50 μmol/kg和250 μmol/kg Cd²⁺处理下,分别鉴定出7084和5071个上调基因,以及7466和3666个下调基因。层次聚类分析显示,许多在对照组中低表达的基因在Cd²⁺处理后被上调。韦恩图显示,有945个DEGs共同响应不同浓度的Cd²⁺胁迫。GO功能分类分析显示,DEGs主要注释到细胞过程、代谢过程、结合、催化活性和转运活性等功能条目。进一步的GO富集分析显著富集了金属离子转运(BP)、液泡(CC)和金属离子跨膜转运活性(MF)等条目,暗示金属离子转运过程在红豆草的Cd²⁺耐受性中起关键作用。KEGG通路富集分析表明,DEGs显著富集于苯丙烷生物合成、淀粉和蔗糖代谢、植物激素信号转导、谷胱甘肽代谢、MAPK信号通路和ABC转运蛋白等通路,这表明响应Cd²⁺胁迫的调控和解毒机制是复杂的 (Fig. 2 A, B, C, D)。
图2. 不同Cd处理下差异表达基因(DEGs)的分析。 (A) 展示Cd0_vs_Cd50、Cd50_vs_Cd250和Cd0_vs_Cd250三个比较组中上调和下调DEG数量的柱状图。(B) 三个比较组中DEG的韦恩图。(C) Cd胁迫响应性DEGs的GO功能分类。基因分布于生物学过程、分子功能和细胞组分三大GO类别中。(D) 来自Cd0_vs_Cd50_vs_Cd250比较组的DEGs的KEGG通路富集分析。图中显示了富集到每个通路的基因数量和富集率(百分比)。
3.3. OvHMA基因的鉴定、系统发育关系、染色体分布及共线性分析
基因鉴定: 在红豆草基因组中鉴定出45个非冗余的OvHMA转录本,源自40个不同的基因位点。
蛋白表征: 预测了OvHMA蛋白的理化性质,并发现OvHMA3编码的蛋白独特性地定位于液泡膜。
进化分析: 系统发育树将45个OvHMA转录本分为P-1B-1、P-1B-2和P-1B-4三个亚进化枝。
基因组分析: 基因复制和共线性分析表明,HMA家族在红豆草中经历了显著扩张。
转录组数据显示,HMA家族在上调的DEGs中显著富集。鉴于其在重金属离子主动转运和区室化中的既定作用,推测HMA是导致红豆草根部Cd固存表型的关键贡献者。在红豆草基因组中共鉴定出45个非冗余的OvHMA转录本(源自40个不同的基因位点),编码40个独特的HMA蛋白序列。这种差异归因于可变剪接。对这些蛋白的理化性质分析表明,其长度、分子量、等电点等指标各异。亚细胞定位预测显示,大多数成员定位于质膜,而OvHMA3转录本编码的蛋白则被独特性地预测定位于液泡膜。利用来自A. thaliana、O. sativa、M. truncatula和红豆草的HMA蛋白构建的系统发育树,将45个OvHMA转录本分为三个亚进化枝。染色体分布分析显示了这45个OvHMA转录本的位置。基因复制分析表明HMA家族在红豆草中有显著扩张。种间共线性比较显示,37个OvHMA基因位点与M. truncatula基因组存在共线性,15个与O. sativa基因组存在共线性 (Fig. 3 A, B, C, D)。
图3. 红豆草中OvHMA基因家族的系统发育关系、染色体分布和共线性分析。 (A) 来自红豆草、M. truncatula和O. sativa的HMA蛋白的系统发育树。(B) OvHMA基因的染色体分布。45个转录本(源自40个基因位点)被映射到其染色体位置。(C) 红豆草中OvHMA基因位点的基因组内共线性分析。(D) 红豆草、M. truncatula和O. sativa之间OvHMA基因位点的基因组间共线性。
3.4. OvHMAs的基因结构、保守基序和顺式调控元件分析
OvHMA蛋白的保守基序数量为5至10个,同一亚家族的成员通常共享相似的基序组成。对OvHMAs基因结构的分析显示,HMA结构域可分为三种不同类型,同一亚家族内的基因通常含有相似的结构域架构。根据GXF注释文件,内含子数量范围为4至23个,外显子数量范围为5至24个 (Fig. 4)。在OvHMAs的启动子中鉴定出潜在的顺式调控元件,表明它们参与了植物生长发育、激素信号和胁迫响应等多种生物学过程。在与生长发育相关的顺式作用元件中,检测到O₂-site、CAT-box和GCN4-motif等元件。激素相关的调控元件包括脱落酸响应元件(ABRE)、生长素响应元件(AuxRR-core)、茉莉酸甲酯响应元件(TGACG-motif)、赤霉素响应元件(P-box)和水杨酸响应元件(TCA-element)。在胁迫响应元件中,特别关注与重金属胁迫直接相关的金属响应元件(MRE)。此外,还鉴定出与干旱(MYB)、低温(LTR)和厌氧胁迫(ARE)相关的元件 (Fig. 5)。
图4. OvHMA家族的保守基序和基因结构分析。 (A) 通过MEME预测的OvHMA蛋白中的保守基序,以不同颜色的方框表示。(B) 保守基序在OvHMA转录本中的分布。(C) OvHMA转录本的外显子-内含子结构。线条表示内含子,黄色矩形表示编码序列,绿色矩形表示非翻译区。
图5. OvHMA基因启动子区域的顺式作用元件。 分析的启动子序列选自起始密码子上游的2000 bp区域。不同颜色的方框代表不同类型的顺式作用元件,相应方框内的数字表示每种元件类型的数量。
3.5. 镉胁迫下OvHMA基因的表达模式
表达分化:OvHMA转录本在Cd胁迫下表现出不同的调控模式,部分上调,部分下调。
剂量依赖:OvHMA3等多个转录本的表达随Cd浓度升高而增强,呈清晰的剂量依赖性。
表达验证: qRT-PCR分析验证了RNA-seq数据的可靠性,两者表达趋势一致。
基于45个OvHMA转录本,进一步分析了它们在Cd胁迫下的表达模式。与对照组(Cd0)相比,OvHMA2、OvHMA4等转录本在50 μmol/kg Cd(Cd50)处理下上调,而OvHMA3、OvHMA6等在250 μmol/kg Cd(Cd250)处理下表达增加。相反,OvHMA8、OvHMA17和OvHMA32在Cd暴露后下调。值得注意的是,OvHMA3、OvHMA14、OvHMA18、OvHMA39、OvHMA42、OvHMA44和OvHMA45的表达水平随Cd浓度的升高而逐渐增加,表现出清晰的剂量依赖性响应。这些结果表明OvHMA转录本在Cd胁迫下表现出独特的调控模式。其中,OvHMA3转录本的表达强度随胁迫水平的增加而持续增强,表明该异构体可能在红豆草根系的Cd耐受性中扮演核心角色。为验证转录组数据的可靠性,随机选取了五个OvHMA转录本基因(OvHMA2、OvHMA3、OvHMA12、OvHMA39和OvHMA42)进行qRT-PCR分析,结果证实其表达趋势与RNA-seq数据一致 (Fig. 6 A, B–F)。
图6. 不同Cd胁迫条件下OvHMA基因家族的转录特征。 (A) 基于RNA-seq数据在Cd0、Cd50和Cd250胁迫下的表达谱。红色表示高表达水平,蓝色和白色分别代表低表达和无表达。色标代表行Z-scores(每个基因的标准化表达值)。(B–F) 在Cd0、Cd50和Cd250处理下五个OvHMA转录本的RT-qPCR分析。数据使用Ms18S rRNA基因作为内参进行归一化。柱状图代表qRT-PCR结果,折线图代表来自RNA-seq数据的DEGs的FPKM。每个样品的三个生物学重复用于qRT-PCR分析。误差棒代表±SE(n = 3)。
3.6. OvHMA3:根系特异性表达与液泡区室化
qRT-PCR分析进一步证实了OvHMA3的组织特异性表达:在250 μmol/kg Cd胁迫下,其在根组织中的表达分别比茎和叶组织显著增加了2.16倍和2.00倍(P < 0.01)。共聚焦显微镜观察显示,OvHMA3-GFP融合蛋白的绿色荧光信号与液泡膜标记(VAC-mCherry)特异性共定位,而空载体对照组的荧光信号则呈弥散的细胞质分布。这些结果表明OvHMA3蛋白具有明确的液泡膜定位,这与其在Cd²⁺跨膜转运中的预测功能相符 (Fig. 7 A, B)。
图7. OvHMA3在烟草叶片表皮细胞中的亚细胞定位和表达模式。 (A) OvHMA3的亚细胞定位。标尺:20 μm。pCAMBIA1300–35S-VAC-mCherry被用作液泡膜标记。(B) 在Cd0、Cd50和Cd250处理下,OvHMA3在根、茎和叶中的表达模式。
3.7. OvHMA3在酵母中的异源表达
在SD-Ura平板上,携带空载体pYES2.0和重组载体pYES2.0-OvHMA3的酵母菌株之间未观察到显著的生长差异。然而,在50 μM CdCl₂胁迫下,表达OvHMA3的菌株表现出显著增强的Cd²⁺耐受性。在添加了50 μM CdCl₂的液体培养中,表达OvHMA3菌株的生长优势在6小时后变得明显,其OD₆₀₀值为0.55 ± 0.03,比空载体对照(0.28 ± 0.03; P < 0.001)增加了96.4%。这种生长差异随时间扩大:到24小时,重组菌株的OD₆₀₀达到1.81 ± 0.21,比对照(1.05 ± 0.05; P < 0.001)高1.72倍。48小时后,重组菌株保持强劲生长(OD₆₀₀ = 2.37 ± 0.11),而对照菌株的生长则进入平台期(OD₆₀₀ = 1.29 ± 0.09; P < 0.0001) (Fig. 8 A, B, C)。
图8. OvHMA3在酵母中Cd转运功能的验证。 (A和B) 表达OvHMA3的酵母细胞在含0和50 μM CdCl₂的SD-Ura琼脂平板上的生长表现。(C) 酵母细胞在暴露于Cd胁迫后随时间变化的生长曲线。
3.8. OvHMA3增强拟南芥的镉耐受性和积累
表型增强: 过表达OvHMA3的拟南芥品系在Cd胁迫下表现出增强的耐受性。
氧化减轻: 转基因品系中氧化损伤指标(H₂O₂、O₂·⁻、MDA)显著低于野生型。
根部固存:OvHMA3过表达有效将Cd限制在根部,根-茎积累比显著提高。
能量依赖: 转基因品系根部ATP含量显著升高,支持了该区室化过程为能量依赖性。
为研究OvHMA3在调控拟南芥中Cd积累的作用,选取了三个独立的35S::OvHMA3过表达T₂系(OE1, OE3, OE9)进行深入的表型分析。在50 μmol/kg CdCl₂处理下,OvHMA3过表达系比野生型Col-0表现出更强的Cd耐受性。DAB和NBT组织化学染色显示,Cd处理后野生型植物叶片中积累了大量的H₂O₂和O₂·⁻,染色显著深于转基因系。进一步的定量生理分析表明,过表达系的氧化损伤显著降低,MDA含量平均比野生型减少约35.24%。在Cd胁迫下,野生型植物的GSH含量急剧增加至220.33 ng/g,而在过表达系中则维持在约111.01 ng/g,进一步证实了转基因植物中氧化应激的减轻。与这些发现一致,对Cd处理植物的基因表达分析显示,转基因系根部中谷胱甘肽合成的关键基因GSH1和植物螯合肽合成的关键基因PCS2显著上调,表明OvHMA3通过GSH依赖的植物螯合肽生物合成途径调控Cd耐受性。离子含量测定表明,OvHMA3过表达有效地将Cd限制在根部。根中的Cd含量显著高于叶片,根-茎积累比约为5.31:1,而野生型中仅为约1.48:1。这种根部特异性的高Cd积累模式,加上根部相对于叶片显著更高的ATP含量,共同支持了该区室化过程可能是能量依赖性的观点。推测能量被用于液泡膜上的主动转运过程,以增强根部的Cd固存 (Fig. 9 A, B, C, D, E, F, G, H, I, J)。
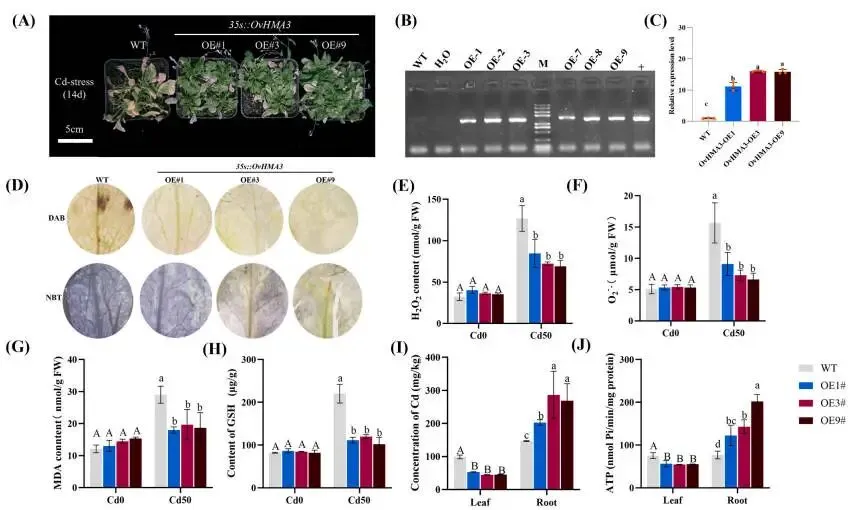
图9. 野生型和过表达OvHMA3的拟南芥对Cd胁迫的表型和生理指标。 (A) CdCl₂处理下的表型。标尺:5 cm。(B) 六个转基因系中OvHMA3转基因插入的PCR验证。使用靶向转基因插入位点的特异性引物进行PCR扩增,产物通过琼脂糖凝胶电泳分析。H₂O(无模板)和WT(野生型)作为阴性对照,pBI121-OvHMA3质粒(+)作为阳性对照(含有目标片段)。(C) 转基因系OE1、OE3和OE9中OvHMA3的相对表达水平。(D) DAB和NBT染色。(E) 拟南芥叶片中的H₂O₂含量。(F) 拟南芥叶片中的O₂·⁻含量。(G) 拟南芥叶片中的MDA含量。(H) 拟南芥叶片中的GSH含量。(I) 50 μmol/kg Cd处理下WT和转基因植物叶片和根中的Cd含量。(J) 50 μmol/kg Cd处理下WT和转基因植物叶片和根中的ATP含量。不同字母表示Cd胁迫与对照之间存在显著差异(P < 0.05)。误差棒代表±SE(n = 4)。