项目文章 | 肠肝轴互作新突破!中国农业科学院揭示甘露糖通过肠肝轴代谢重编程改善脂肪肝
- 2026-02-12 02:35:28


肠道菌群与宿主之间存在着复杂的互作关系,其代谢产物是影响宿主生理与代谢功能的关键媒介。既往研究已知,短链脂肪酸、次级胆汁酸、吲哚衍生物等菌群代谢物可通过血液循环影响远端器官,其中“肠道-肝脏轴”作为重要的双向通讯渠道,与肝脏健康密切相关。高脂饮食是诱导肝脏脂肪变性(即脂肪肝)和肠道菌群失调的经典模型,但迄今为止,大多数研究聚焦于菌群代谢物对肝脏的直接影响,尚缺乏菌群代谢物在肝脏内经过宿主“二次加工”后产生有益效应的明确例证。因此,探索是否存在此类经由宿主肝脏转化、最终发挥保护作用的新型菌群代谢通路,具有重要的科学意义。
2025年,中国农业科学院饲料研究所等团队于期刊《iMeta》(if=33.2)上发表了题为“Host‐driven hepatic conversion of gut microbiota‐derived putrescine to spermidine mediates mannose's protective effects against hepatic steatosis in zebrafish”的研究文章。该研究综合运用代谢组学等技术,深入探究了膳食补充剂“甘露糖”如何通过调节特定肠道细菌,产生代谢物腐胺,并最终在肝脏中转化为具有保肝作用的亚精胺,从而缓解高脂饮食诱导的肝脏脂肪变性。这项成果不仅揭示了一种全新的肠道-肝脏轴代谢对话机制,也为通过膳食干预调控菌群以改善代谢健康提供了新的科学依据。
迈维代谢为本研究提供了全谱plus代谢组检测服务。


本研究以斑马鱼为动物模型,系统探讨了甘露糖缓解高脂饮食诱导肝脏脂肪变性的机制。研究首先设立正常脂肪饮食、高脂饮食及高脂饮食添加不同剂量甘露糖的饲喂组,评估其对肝脏脂肪积累、炎症及肠道健康的影响。随后,通过16S rRNA测序分析肠道菌群结构变化,并结合基因组学与体外培养技术,锁定关键菌种。进一步地,利用代谢组学、靶向代谢物定量及稳定同位素(¹³C/¹⁵N、D₈)示踪技术,在细菌培养体系、斑马鱼肝脏细胞及活体斑马鱼中,逐级解析了从膳食甘露糖到肠道细菌代谢,再到宿主肝脏转化的完整代谢途径与功能验证。

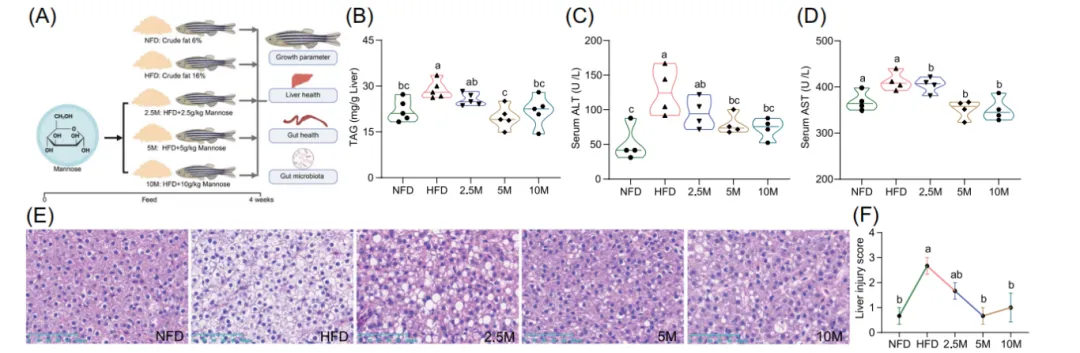
1. 甘露糖补充有效缓解高脂饮食诱导的斑马鱼肝脏脂肪变性与炎症
研究首先证实,在高脂饮食中添加甘露糖(5 g/kg和10 g/kg剂量)干预四周后,能显著逆转高脂饮食引起的肝脏病理变化。具体表现为:肝脏甘油三酯含量显著降低,血清中反映肝细胞损伤的关键指标——谷丙转氨酶和谷草转氨酶水平明显下降。肝脏组织切片显示,代表脂滴的空泡数量大幅减少,肝脏损伤评分接近正常饮食组。与此同时,肝脏中与脂肪合成相关的基因表达下调,促炎细胞因子表达也受到抑制。这一系列数据表明,甘露糖干预对高脂饮食引发的肝脏脂肪变性(俗称“脂肪肝”)和伴随的炎症反应具有明确的改善作用。
■■■■■
图1. 甘露糖补充对高脂饮食斑马鱼肝脏健康的影响
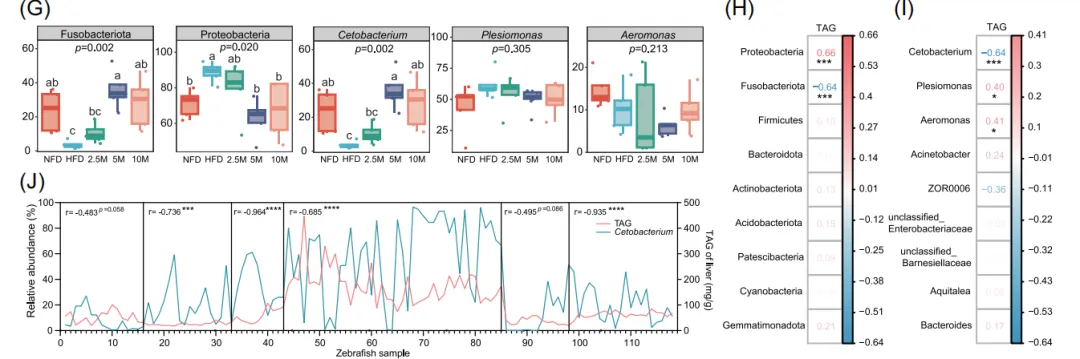
2. 甘露糖选择性促进肠道中Cetobacterium somerae的生长
深入分析肠道微生物组成发现,甘露糖的补充显著改变了斑马鱼的肠道菌群生态。其效果并非普遍提高多样性,而是进行了“精准调控”:变形菌门等与肝脏脂肪含量正相关的菌群丰度下降,而梭杆菌门丰度显著上升。在属水平上,梭杆菌门中的Cetobacterium(最终鉴定为C. somerae)成为甘露糖干预后最显著富集的细菌。相关性分析进一步显示,C. somerae在肠道中的相对丰度与肝脏脂肪含量呈现强烈的负相关关系,即该菌越多,肝脏脂肪越少。这一关联不仅在本次实验中得到验证,还在公开的其他鱼类研究数据集中得到重复,强化了C. somerae作为关键有益菌角色的可靠性。这表明甘露糖的保肝效应很可能是通过定向促进特定肠道细菌的生长来实现的。
■■■■■
图2. 甘露糖对肠道菌群组成的影响及其与肝脏脂肪的相关性
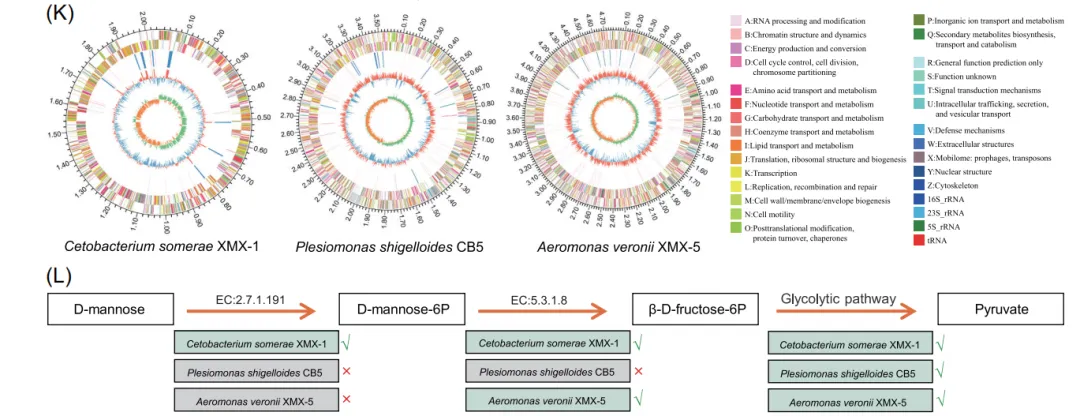
3. 基因组和生长分析揭示了C. somerae 代谢甘露糖的能力
为探究添加甘露糖后肠道菌群丰度变化的原因,作者对选定斑马鱼肠道细菌菌株进行了全基因组测序分析,结果显示C. somerae 含有完整的甘露糖代谢通路基因,体外生长实验进一步证实其能够以甘露糖作为主要碳源进行增殖,从遗传与生理层面解释了该菌在甘露糖干预下被特异性富集的原因。
■ ■ ■ ■ ■
图3. 关键菌株的基因组特征与甘露糖代谢基因注释
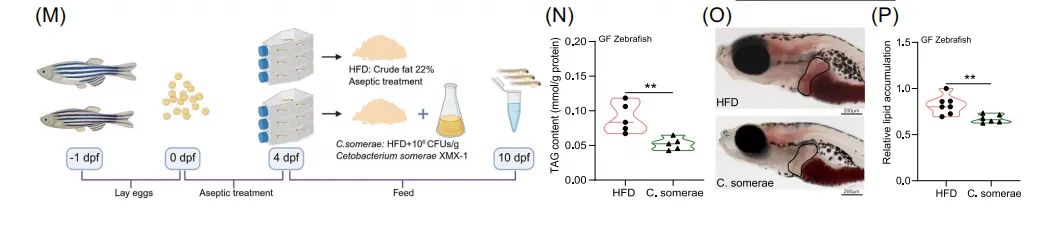
4. 无菌动物模型证实,是肠道C. somerae而非甘露糖本身发挥了减少肝脏脂肪积累的核心作用
为明确甘露糖的保护作用是直接的还是通过肠道菌群介导,研究使用了无菌斑马鱼模型进行验证。在完全无菌的条件下,直接饲喂甘露糖补充的高脂饮食,未能降低肝脏脂肪含量,亦未改变脂代谢与炎症相关基因的表达。这证明甘露糖本身并非直接的保肝分子。相反,当在无菌斑马鱼的高脂饮食中直接补充活菌 C. somerae 时,肝脏甘油三酯含量和油红染色所示的脂滴沉积均被显著降低,且脂代谢与炎症相关基因表达得到改善。作为对照,其他肠道菌(如P. shigelloides和A. veronii)的补充则无此效果。这一系列对照实验证明,在甘露糖干预中,真正的功效执行者是它所富集的有益菌 C. somerae,而非甘露糖本身。
■ ■ ■ ■ ■
图4. 无菌斑马鱼模型验证C. somerae的直接保肝作用
5. C. somerae 具备代谢精氨酸并合成腐胺的完整遗传与代谢能力
为了探究C. somerae在HFD下改善宿主肝脏健康的机制,我们结合了基因组学和代谢组学分析,并结合LC-MS靶向定量和同位素示踪方法,来确定C. somerae参与降低肝脏脂肪含量的活性成分。在代谢物层面,通过代谢组学对细菌培养上清与无菌培养基进行比较,主成分分析区分两组代谢谱,最终筛选出腐胺为C. somerae分泌的关键差异代谢物之一。进一步通过靶向代谢组学定量及稳定同位素示踪技术(使用 ¹³C/¹⁵N 标记的精氨酸),研究直接验证了C. somerae具备将精氨酸高效转化为腐胺的完整代谢通路。
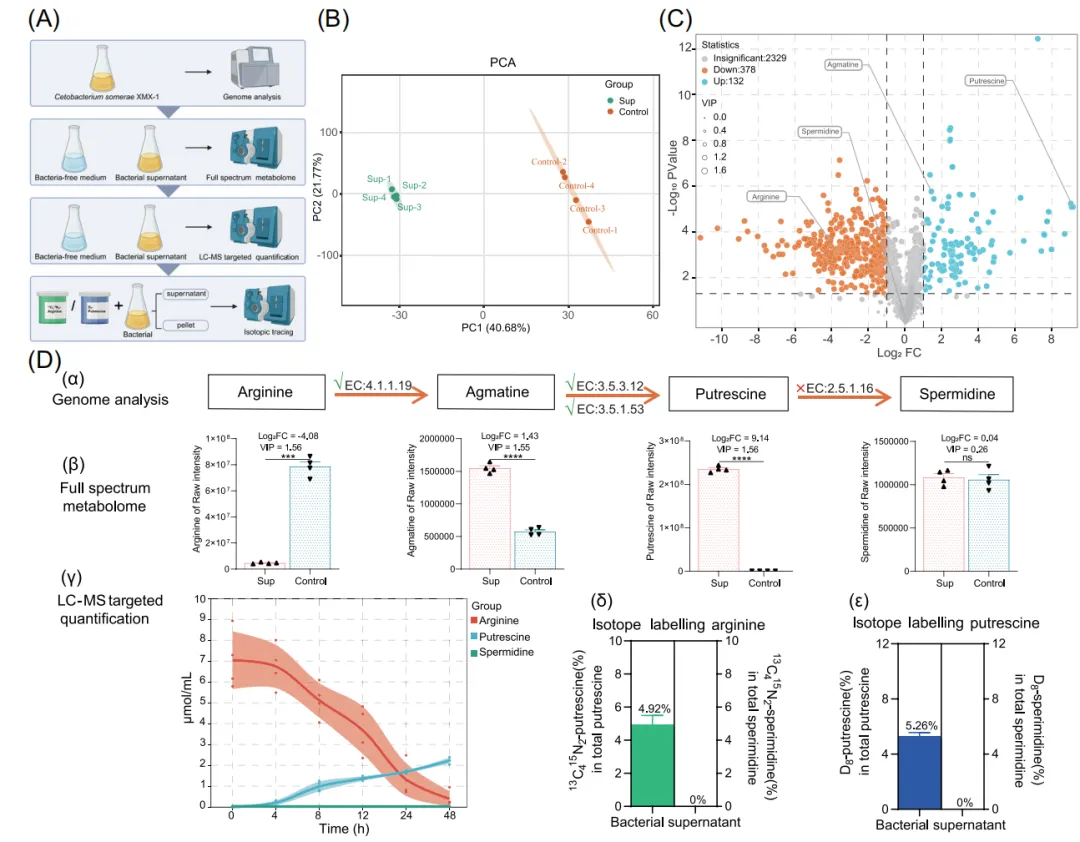
■ ■ ■ ■ ■
图5. C. somerae 具备代谢精氨酸并合成腐胺的完整遗传与代谢能力
6. 腐胺本身并非直接效应分子,需经肝脏转化为亚精胺方能发挥保肝作用
尽管C. somerae产生大量腐胺,但研究人员注意到两个关键事实:第一,C. somerae自身基因组中缺乏合成亚精胺(一种已知具有抗衰老和代谢益处的多胺)的关键酶——亚精胺合酶;第二,在细菌培养上清中也未检测到亚精胺。相反,生物信息学分析显示斑马鱼基因组编码有功能的亚精胺合酶。随后的细胞实验证明,斑马鱼肝脏细胞能将外源添加的标记腐胺高效转化为标记亚精胺。功能验证实验发现,在肝脏细胞和斑马鱼幼体中,直接添加腐胺或亚精胺都能降低脂肪积累。然而,当利用基因沉默技术特异性敲低肝脏细胞的亚精胺合酶后,腐胺的降脂效应完全消失,而直接添加亚精胺仍然有效。这决定性的一步证明,腐胺本身并非直接的功能分子,它必须作为“前体”,在宿主肝脏中被加工成最终的“执行者”——亚精胺后,才能发挥改善肝脏脂肪代谢的作用。
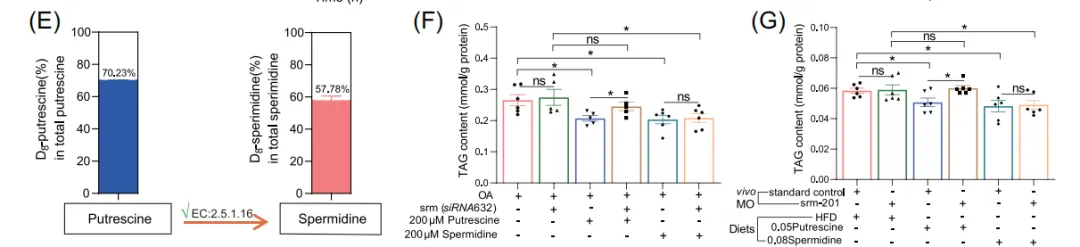
■■■■■
图6. 肝脏将腐胺转化为亚精胺的能力验证及其在缓解脂肪变性中的必要性
7. 肠道来源的腐胺可转运至肝脏并被高效转化为亚精胺,构成一条完整的肠-肝代谢轴
活体同位素示踪实验表明,经口给予的标记腐胺能被肠道吸收并进入血液循环,最终抵达肝脏。在肝脏中,高达84.5%的标记腐胺被转化为亚精胺,且肝脏中亚精胺的稳态水平远高于腐胺。并通过HFD斑马鱼模型进一步验证腐胺和亚精胺的降脂作用。补充甘露糖或直接补充C. somerae 的斑马鱼,其肝脏中的腐胺和亚精胺水平均显著高于HFD组,肝脏中腐胺和亚精胺的含量呈显著正相关,进一步证实肝脏是腐胺向亚精胺转化的核心场所。
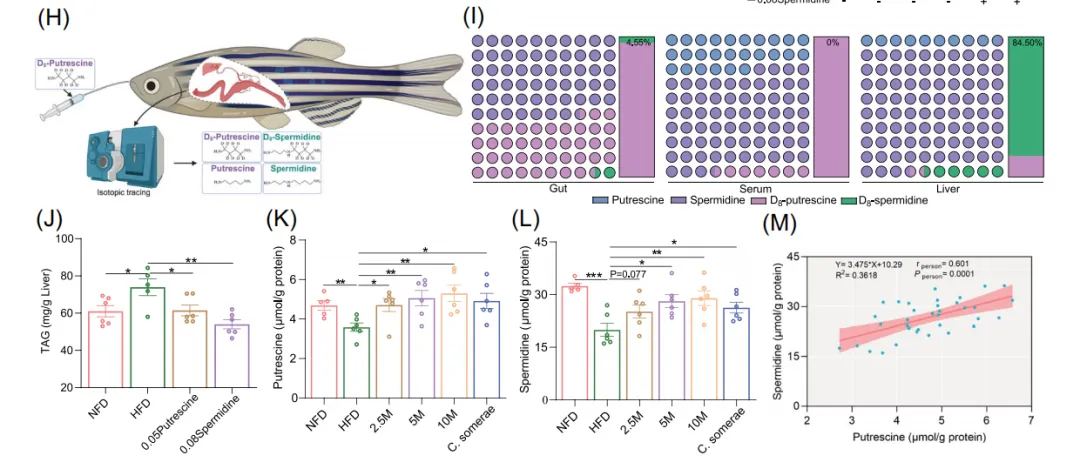
■■■■■
图7. 肠道腐胺向肝脏亚精胺转化的体内验证及其生理意义

本研究系统阐明了一条全新的肠道-肝脏轴保护性代谢通路:膳食甘露糖→促进肠道C. somerae生长→该菌利用精氨酸产生腐胺→腐胺经血液循环转运至肝脏→肝脏亚精胺合酶将其转化为亚精胺→亚精胺最终发挥缓解肝脏脂肪变性和炎症的作用。该发现首次揭示了肠道菌群代谢物可在宿主肝脏中进行“二次加工”从而产生有益效应的完整机制,突破了以往菌群代谢物直接作用的认知框架,为理解宿主-微生物共代谢及其在代谢性疾病中的干预价值提供了创新视角。未来,针对“腐胺-亚精胺”轴进行膳食或菌群定向调控,可能为脂肪肝等代谢性疾病的防治提供新策略。





如有侵权,联系删除。
