北京林业大学本科毕业、发表校史首篇《Nature》和《Cell》论文,“优青”团队在《Nature》子刊再获进展,破解细菌“同归于尽”抗病毒策略
- 2026-02-12 14:56:12
近日,北京化工大学冯越教授与张怡副教授团队携手中国科学技术大学生命科学与医学部张凯铭教授团队,在《Nature Chemical Biology》上发表了一项重要研究成果,题为《Structural insights into type-I and type-II Lamassu antiphage systems》。这是冯越教授作为通讯作者在该期刊上发表的第四篇论文。研究通过解析I型和II型Lamassu抗噬菌体系统在多种功能状态下的高分辨率冷冻电镜结构,并结合体外生化实验与噬菌体防御功能验证,首次完整揭示了这一“细胞自杀”防御机制如何被精准调控。值得一提的是,冯越教授早在2012年,尚在清华大学攻读博士学位期间,就以第一作者发表了个人首篇《Nature》论文。2018年,其课题组在《Nature》上发表的研究成果,成为北京化工大学校史首篇《Nature》论文;2023年,又发表了校史首篇《Cell》论文;2024年和2025年,冯越团队再度于《Nature》和《Cell》刊发重要研究成果。点击阅读:
北京林业大学本科毕业、第一作者发Nature,入职双一流高校两次打破校史!“优青”两发Nature和Cell,发现细菌"杀手锏"

在微观世界中,细菌与其天敌——噬菌体之间持续上演着一场没有硝烟的军备竞赛。为了抵御病毒入侵,细菌演化出多种防御策略,其中最为极端的一类被称为“流产感染”(Abortive infection, Abi):一旦个体被噬菌体感染,便会主动启动程序性死亡或生长停滞,以牺牲自身的方式阻止病毒复制和扩散,从而保护整个菌群。据估计,超过70%的原核生物都拥有这类防御机制。Lamassu系统正是在2018年被发现的一种新型Abi系统,包含I型和II型两种变体,能够特异性识别噬菌体DNA中的回文序列等特征,进而激活防御反应。然而,尽管对其组成蛋白已有初步功能预测,其整体组装逻辑与激活机制长期以来仍是一个未解之谜。
本研究中,联合团队首先发现Lamassu系统的核心结构是由SMC(染色体结构维持蛋白)家族成员LmuB构成的二聚体支架,形似一把巨大的分子“钳子”。在II型系统中,这一钳子中央还嵌入了一个独特的LmuC组分。在未受感染的“静息态”下,执行杀伤功能的核酸酶LmuA以单体形式被牢牢“锁”在LmuB的螺旋结构域上,处于非活性状态——如同武器上了保险栓,有效防止对宿主自身DNA造成误伤。随后,研究团队成功解析了两种Lamassu系统与DNA底物结合的复合物结构,并通过体外切割实验证实:不同于传统SMC复合物通过头部环抱DNA的方式,Lamassu系统特异性识别并结合双链DNA的“末端”。这种末端结构通常只在噬菌体大量复制或宿主基因组受损时才会暴露,因此成为系统感知危险的关键信号。
更引人注目的是,研究还揭示了一种双重调控机制:当细胞内ATP浓度较高(代表健康状态)时,系统的核酸酶活性受到抑制;而当ATP水平下降(常因噬菌体劫持代谢导致能量耗竭),系统则更容易与DNA结合并启动切割。这一发现表明,Lamassu不仅感知外来DNA的异常末端,还同步监测细胞的能量状态,从而实现高度精准的激活控制。此外,团队捕捉到了关键的激活瞬间——噬菌体DNA的结合触发了LmuA从LmuB支架上的释放,游离的LmuA单体随即发生构象变化,在细胞质中迅速组装成具有高度活性的四聚体。这个四聚体如同一台失控的“DNA碎纸机”,无差别地降解细胞内所有遗传物质,最终导致受感染细菌死亡,彻底阻断噬菌体的传播链条。
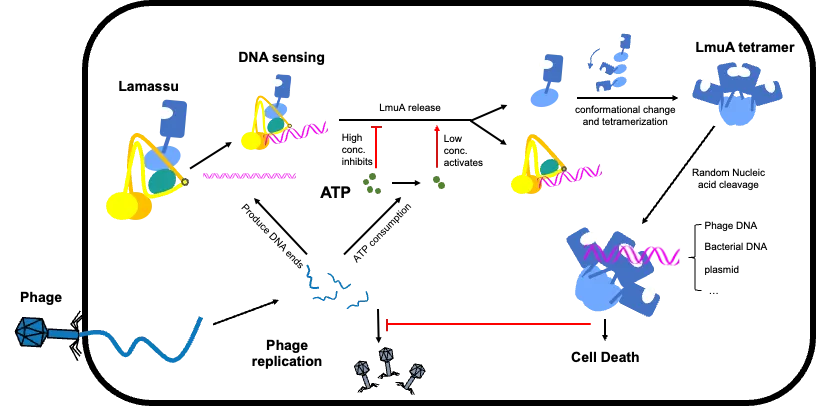
这项工作不仅首次描绘出Lamassu系统从静息到激活的完整分子动态图景,更拓展了人们对SMC家族蛋白功能的认知:它们不仅是染色体结构的守护者,还在原核免疫防御中扮演着核心支架的角色。同时,LmuA从单体到四聚体的激活路径,也为理解细菌如何通过蛋白质多聚化精确调控免疫应答提供了全新的理论框架。
该论文的共同第一作者为中国科学技术大学博士研究生李明、博士后赵晓龙,以及北京化工大学博士研究生赵兴雨、李栋和熊伟佳;通讯作者为北京化工大学生命科学与技术学院冯越教授、张怡副教授,以及中国科学技术大学生命科学与医学部张凯铭教授。

