《食品科学》:中国农业科学院谢纯良研究员等:植物乳植杆菌发酵对人参体外模拟消化中活性物质含量及功能活性的影响
- 2026-02-09 03:23:09
人参(Panax ginseng C.A. Mayer)为五加科人参属多年生草本植物,主产于中国东北地区,是我国的新资源食品和药食同源的中药材品种。现代成分学研究表明,人参的核心活性成分主要为人参皂苷(如Rb1、Rg1、CK等)、人参多糖及多酚类物质。然而,原型人参皂苷分子质量大、极性高,在胃肠道消化过程中易受胃酸和酶解作用影响,需要转化为小分子稀有皂苷才能充分发挥其功效,这大大制约了人参功能性食品的开发与应用。
近年来,乳酸菌发酵技术因其在提升植物基质活性成分方面的潜力而备受关注。研究表明,乳酸菌通过分泌β-葡萄糖苷酶等酶类可裂解人参皂苷的糖苷键,将大分子原型皂苷转化为生物利用度更高的小分子稀有皂苷。目前,体外模拟消化模型是研究人体消化吸收的常用模型,是评估食品活性成分生物可及性的重要工具。
中国农业科学院麻类研究所的郑志豪、李晓春和谢纯良*等人以植物乳植杆菌(Lactiplantibacillus plantarum)SJ12发酵人参为研究对象,通过整合体外模拟口腔-胃-肠3 段消化模型、高效液相色谱(HPLC)技术及多功能活性评价体系,系统阐释人参活性成分在发酵-消化协同作用下的转化机制,并评估其功能活性变化。重点揭示植物乳植杆菌发酵对人参皂苷组成的调控效应及其在胃肠消化过程中的动态释放规律,探究发酵预处理与消化环境(胃酸作用、胰酶水解)的协同增效作用是否通过促进稀有人参皂苷的生物转化,从而显著提升消化产物的功能活性。本研究将发酵与体外消化模型结合,系统解析人参活性成分的转化规律与功能提升机制,以期为高生物利用度人参功能性食品的开发提供理论依据,同时为传统中药材的现代化加工与利用开辟新思路。

1
乳酸菌发酵对人参体外模拟消化活性物质释放量的影响
由 图 1 A 、 B 可知,未消化时,未发酵人参中总酚和总黄酮释放量分别为(1.83±0.01)mg/g和(0.63±0.01)mg/g;经乳酸菌发酵后,其总酚和总黄酮释放量分别显著提升至(2.08±0.06)mg/g和(1.52±0.10)mg/g(P<0.05),这可能是由于植物乳植杆菌在发酵过程中通过代谢作用促进了人参细胞壁的降解,释放更多结合态活性物质。周克蒙等也研究发现通过益生菌群半固态发酵能够降解甘草植物细胞壁,增加了胞内甘草酸、黄酮等有效成分的释放量。在体外模拟消化过程中,未发酵组与发酵组的总酚释放量总体均呈现上升趋势,且发酵组的总酚释放量在各消化阶段均显著高于未发酵组(图1A)。相比于未消化时的总酚释放量,在口腔消化阶段,未发酵组和发酵组的总酚释放量均略有提高,这可能是淀粉酶通过水解人参细胞壁,使结合态多酚转化为游离态多酚,但由于口腔停留时间较短,两组的总酚释放量变化不显著。进入胃消化阶段,未发酵组总酚释放量在酸性环境下波动较小,胃消化结束时的总酚释放量为(2.01±0.02)mg/g;而发酵组因乳酸菌发酵破坏了细胞壁结构,使结合态多酚被进一步释放,其总酚释放量显著提升至(2.92±0.02)m g / g(P<0.05)。进入肠消化阶段后,在肠消化120 min时未发酵组的总酚释放量上升至(2.80±0.13)mg/g,发酵组则达到峰值((3.65±0.11)mg/g),较未发酵组显著提高30.3%(P<0.05)。这与李诺等关于苦荞酚类物质在肠消化阶段释放量最高的结论相符,可能与胰酶进一步水解结合态多酚为游离态多酚有关。
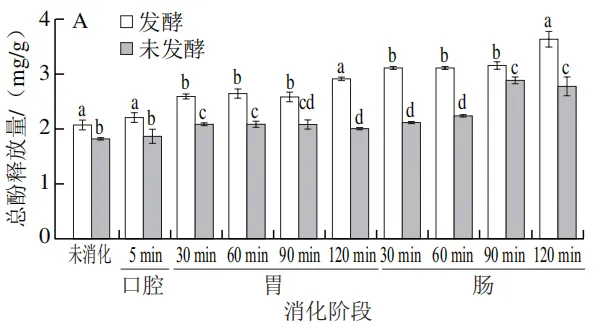 | 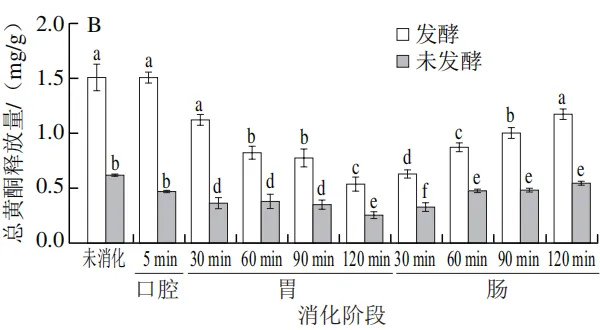 | 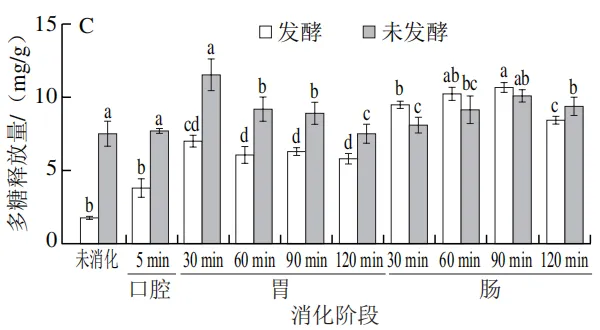 |

发酵组的总黄酮释放量在各消化阶段均显著高于未发酵组(图1B)。在口腔消化阶段总黄酮的释放量变化趋势与总酚相似。值得注意的是,进入胃消化阶段,未发酵组和发酵组的总黄酮释放量均呈现下降趋势,未发酵组的下降幅度较小,由(0.37±0.04)mg/g缓慢下降至(0.26±0.02)mg/g,而发酵组则由(1.13±0.04)mg/g下降至(0.55±0.05)mg/g,这可能是由于胃消化阶段的强酸性环境导致黄酮类物质的化学结构发生变化,尤其是糖苷键的水解和黄酮苷元的释放,导致黄酮类化合物含量下降。或是在酸性条件下黄酮类物质与胃蛋白酶以及人参中的蛋白质和多糖通过氢键或疏水作用结合,从而导致游离态黄酮的含量降低。当到达肠消化阶段时,由于肠液的中性环境使酚酸类、花青素类发生降解,多酚结构向更稳定的黄酮类转化,同时在胰酶的作用下促进一些与蛋白质结合的黄酮类物质重新释放。因此,随着肠消化阶段时间的不断延长,总黄酮的释放量逐渐增加,发酵组在肠消化2 h后总黄酮释放量达到(1.18±0.04)mg/g。李贻等的研究表明,胆盐以及胰酶能促进贵州刺梨中多酚、黄酮的释放。
由图1C可知,在未消化时,发酵组的多糖释放量显著低于未发酵组,这可能是由于微生物的生长需要消耗碳源。进入胃消化阶段,未发酵组与发酵组的多糖释放量相比于口腔消化阶段均显著上升,表明胃蛋白酶可以促进多糖的释放,随着胃消化的进行多糖释放量呈现降低的趋势,这可能是多糖的糖苷键在胃的酸性环境和胃蛋白酶共同作用下被破坏,其稳定性降低。这与孙嘉蔚等的研究结果一致。在肠消化阶段发酵组的多糖释放量开始高于未发酵组,在肠消化90 min时发酵组的多糖释放量达到最大值,为(10.66±0.19)mg/g。这可能是因为乳酸菌分泌的多糖降解酶提前将人参多糖分解为小分子片段,其分子质量降低、空间结构松散,更易与肠液中的酶/胆汁盐相互作用从而促进多糖在肠环境中的释放。发酵预处理虽然会使人参的多糖含量降低,但进入肠消化阶段后,发酵预处理却提高了多糖的释放量,反而提高了多糖的生物可及性。
2
消化过程中单体人参皂苷释放量变化
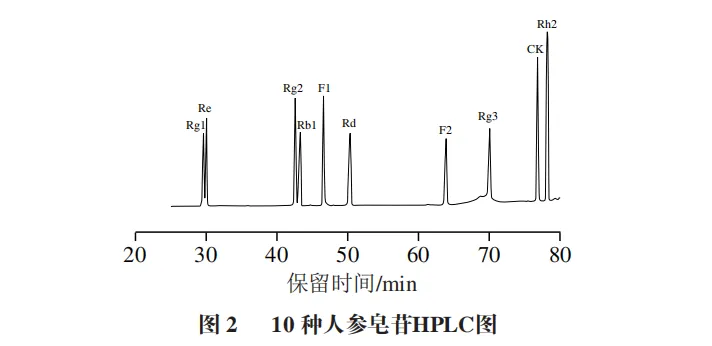
2.1 人参皂苷色谱图
在原文1.3.3.3节的色谱条件下测定人参皂苷标准品,结果如图2所示。以10 种人参皂苷的色谱峰面积作线性回归分析,各标准曲线的线性方程及决定系数见表1,各种人参皂苷峰面积和含量呈良好的线性关系,决定系数均大于0.999。

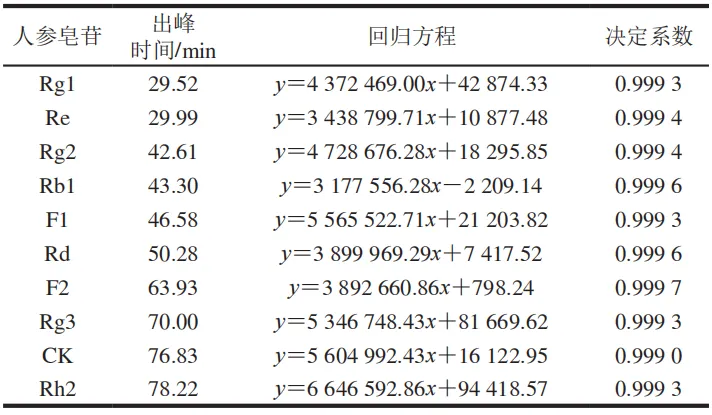
2.2 消化过程中人参皂苷释放量变化及转化途径分析
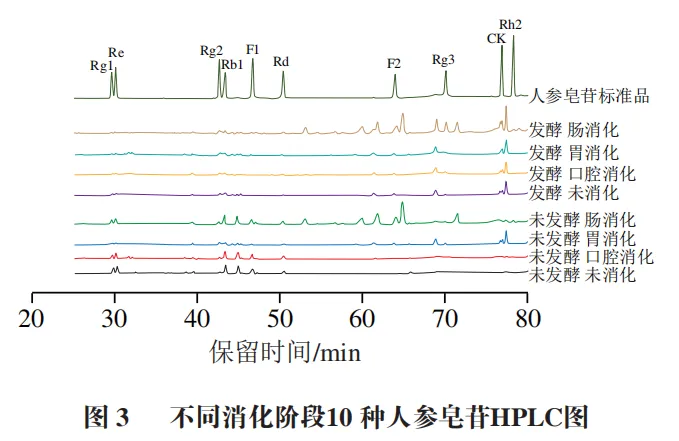
图3为不同消化阶段10 种人参皂苷的HPLC分析结果。由表2可知,未消化时,未发酵组中以Rg1、Re和Rb1为代表的原型人参皂苷初始释放量较高,分别为(3.39±0.14)、( 5.87 ± 0.40 ) m g / g 和 ( 9.63 ± 0.51 ) m g / g ,而F2、Rg3、CK、Rh2等稀有人参皂苷未检出。发酵组以Rg1、Re和Rb1为代表的原型人参皂苷初始释放量相比未发酵组明显降低,分别为(1.31±0.04)、(1.82±0.03)mg/g和(2.53±0.04)mg/g,但F2、Rg3、CK等稀有人参皂苷开始出现。表明通过植物乳植杆菌发酵可以将原型人参皂苷部分转化为稀有人参皂苷。刘士伟等利用植物乳植杆菌发酵人参,在发酵过程中原型人参皂苷Rg1、Re、Rb1和Rc上的糖基经过水解作用,生成新的稀有人参皂苷CK、Rk1、Rh4、Rg5等,这与本实验结果相似。
口腔消化阶段对人参皂苷释放量影响较小,发酵组仍保持F2、Rg3、CK的稳定释放。进入胃消化阶段,在胃酸环境和胃蛋白酶的作用下,未发酵组的Rg1、Re和Rb1持续降解,但稀有人参皂苷的释放仍有限。值得注意的是,未发酵组的Rg1、Re和Rb1在胃消化阶段由初始的(3.39±0.14)、(5.87±0.40)mg/g和(9.63±0.51)mg/g 分别降至(2.07±0.14)、(4.02±0.22)mg/g和(6.44±0.71)mg/g,而在肠消化阶段分别回升至(2.63±0.11)、(5.70±0.30)mg/g和(10.34±0.11)mg/g。这一“先降后升”的趋势可能是因为胃液强酸性环境促使Rb1发生部分酸水解,同时低pH值导致皂苷分子疏水聚集形成沉淀,降低其释放量;进入肠液后中性环境破坏疏水聚集,使沉淀皂苷复溶,胆盐的乳化作用能够提升皂苷溶解度,同时胰酶降解皂苷-基质复合物,释放更多游离态Rg1、Re和Rb1及其转化产物。发酵组因预处理已降解细胞壁及皂苷-基质复合物,且原型皂苷初始含量低,故未观察到显著波动。胃消化阶段发酵组的Rg3、CK释放量持续上升,分别由(0.82±0.08)、( 1.81 ± 0.18 ) m g / g 提升至( 1.12 ± 0.10 ) 、(2.15±0.11)mg/g,这可能是因为皂苷类化合物在强酸性介质中易发生酸催化水解反应,导致其苷元结构解体并伴随多种次级产物的形成。Quan Kai等开发了一种通过酸处理快速生产稀有人参皂苷的转化方法。肠消化阶段是皂苷转化的关键期,未发酵组和发酵组的稀有人参皂苷F2、Rg3和CK释放量均显著增加,其中未发酵组的F2、Rg3和CK释放量最高分别达到(10.21±0.19)、(0.62±0.13)mg/g和(1.59±0.08)mg/g,发酵组的F2、Rg3和CK释放量最高则分别达到了(12.57±0.07)、(8.32±0.54)mg/g和(7.25±0.21)mg/g,相较于未发酵组进一步提升了23.1%、1 241.9%、355.9%。在肠消化阶段Rh2开始释放,未发酵组Rh2释放量最高达到(0.38±0.07)mg/g,发酵组则达到(1.81±0.12)mg/g。未发酵组与发酵组的稀有人参皂苷含量均在肠消化阶段达到峰值。这与韩明冲等关于三七叶在肠消化阶段稀有人参皂苷含量显著升高的结论相符,而在肠消化阶段发酵组的稀有人参皂苷含量显著高于未发酵组,表明发酵显著提高了稀有人参皂苷的生物利用度。
由于Rb1是含量最高的原型人参皂苷,且在消化过程中呈现独特的“先降后升”动态,以及其裂解产物(Rg3、CK、Rh2)与抗氧化及降血糖活性呈极显著正相关,是功能提升的关键。基于此,推断消化过程中人参皂苷Rb1可能的裂解途径为Rb1→Rd→Rg3/F2/CK(胃酸和蛋白酶可能部分水解Rb1生成Rd,肠道酶进一步裂解Rd生成Rg3、F2和CK)和Rg3/F2→Rh2(Rg3/F2在肠道中脱去糖基生成Rh2)。牛华周等对人参皂苷Rb1体外消化产物进行分析,推断消化过程中Rb1降解途径为Rb1→Rd→Rg3→Rg5/Rk1和Rb1→Rd→F2,与本研究结果相一致。上述人参皂苷之间可能的转化路径如图4所示。Rb1裂解途径是基于文献及本实验现象的合理推测,后续需通过实验进一步验证。
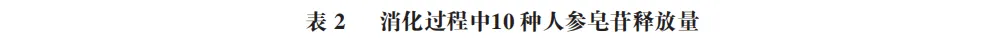
综上所述,发酵通过微生物酶解提前将原型人参皂苷转化为稀有人参皂苷,并显著增强其在肠道中的生物利用度;而未发酵组需依赖消化道环境逐步水解原皂苷,转化效率较低。该机制提示发酵可优化人参皂苷的生物活性,为功能性食品开发提供理论依据。
3
乳酸菌发酵对人参体外模拟消化功能活性的影响
由图5A~C可知,发酵组在各消化阶段的抗氧化能力均显著高于未发酵组(P<0.05)。发酵组的ABTS阳离子自由基清除率、铁离子还原能力和超氧阴离子自由基清除率在肠消化阶段显著提升,最高分别达到(89.22±3.04)%、0.57±0.01和(41.36±0.96)%,较未发酵组分别提升了21.8%、15.2%和141.3%,这一差异可能与稀有人参皂苷(F2、CK、Rg3、Rh2)以及总酚在肠消化阶段的释放量显著升高相关(表2、图1)。稀有人参皂苷因其更强的抗氧化活性,可通过供氢或电子转移机制中和自由基,而发酵预处理通过提前转化原型人参皂苷为活性更高的稀有人参皂苷,显著提升了其抗氧化能力。值得注意的是,超氧阴离子自由基清除能力在胃消化阶段出现短暂下降趋势,可能与胃酸导致部分黄酮类物质降解有关。现有研究也表明抗氧化活性与总酚,总黄酮含量呈正相关。
由图5D可知,发酵组在各消化阶段的α-葡萄糖苷酶抑制率始终高于未发酵组,且随着消化的进行,两组对α-葡萄糖苷酶抑制率总体呈现上升的趋势。在肠消化阶段,发酵组和未发酵组的α-葡萄糖苷酶抑制活性均达到最大值,分别为(83.81±0.71)%和(77.40±1.24)%,发酵组较未发酵组提升了8.3%。这一差异可能与稀有人参皂苷(F2、CK、Rg3、Rh2)以及总酚在肠消化阶段的释放量显著升高相关(表2、图1)。有研究表明,这些活性物质含量与α-葡萄糖苷酶抑制活性相关。
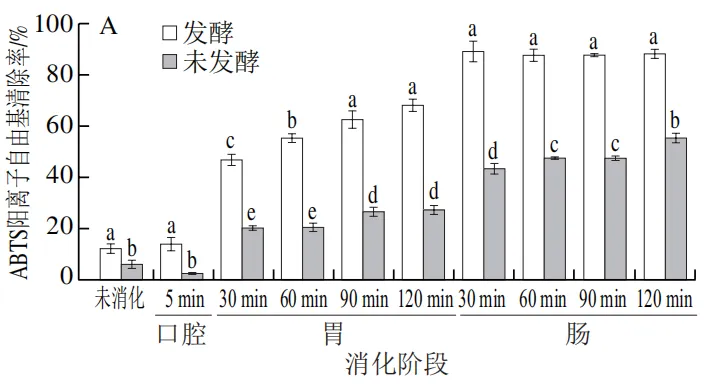 | 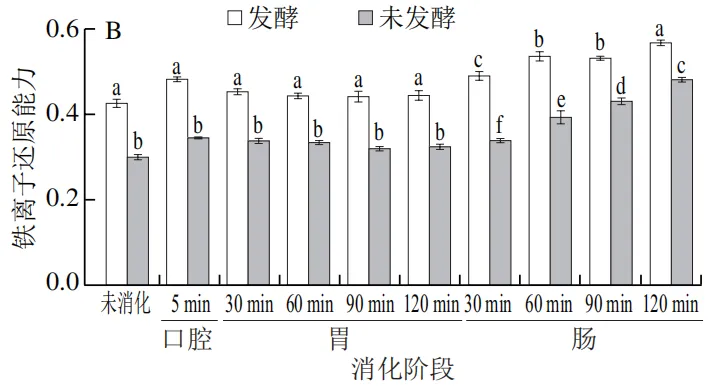 |
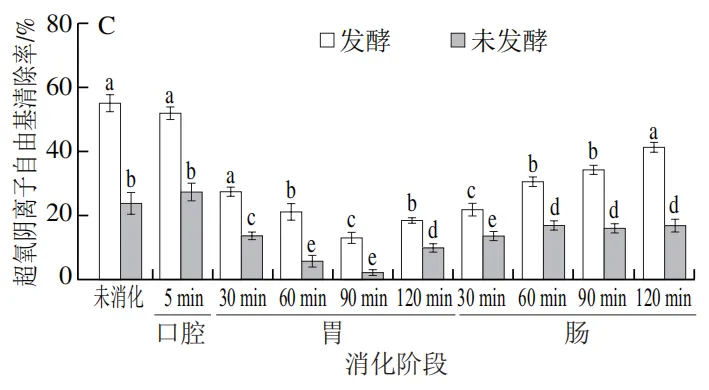 | 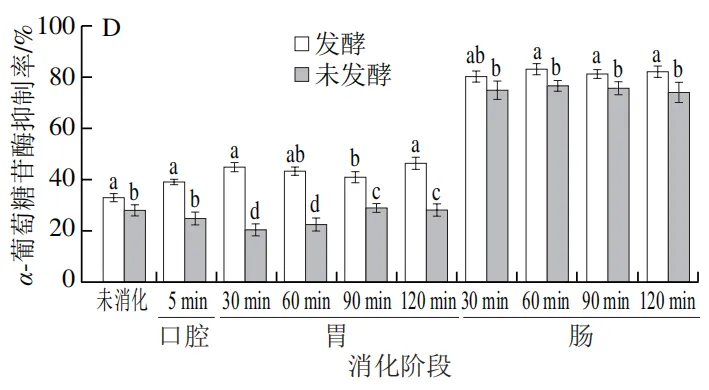 |

4
乳酸菌发酵组消化过程中活性物质含量与体外活性的相关性分析
本研究相关性分析聚焦发酵组,因其通过预处理使活性物质转化更充分,数据稳定性高,可明确揭示“发酵-消化”对功能活性的协同增效机制;未发酵组因消化波动显著,其相关性可能受混杂因素影响,故未纳入分析。图6为乳酸菌发酵组消化过程中活性物质含量与体外活性的相关性分析。从抗氧化特性来看,总酚含量与ABTS阳离子自由基清除率(P<0.001)及铁离子还原能力(P<0.01)呈极显著正相关,证实其通过直接供氢机制主导抗氧化过程。总黄酮含量虽与超氧阴离子自由基清除率呈高度显著相关(P<0.001),但受胃酸环境降解影响,导致其他抗氧化指标表现欠佳。值得注意的是,稀有人参皂苷F2、Rg3、CK和Rh2因苷元结构的空间位阻效应降低,能够显著提升活性氢释放效率,与铁离子还原能力(P<0.001)和ABTS阳离子自由基清除率(P<0.01)呈现强关联性,成为抗氧化体系的核心组分。
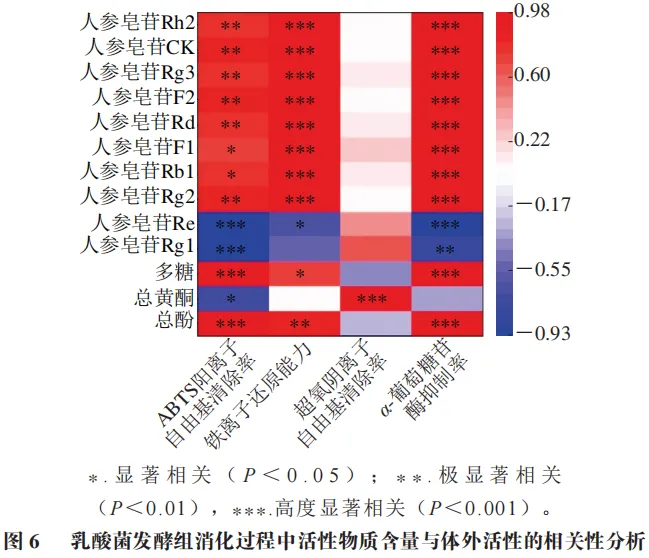
在降血糖机制层面,总酚、多糖、稀有人参皂苷(F2、Rg3、CK和Rh2)含量与α-葡萄糖苷酶抑制率呈高度显著正相关(P<0.001),这说明总酚、多糖协同上述稀有皂苷通过竞争性抑制α-葡萄糖苷酶活性中心,显著提升α-葡萄糖苷酶抑制率。值得注意的是,原型人参皂苷Rg1和Re与抗氧化活性、降血糖活性呈显著负相关,这为稀有人参皂苷比原型人参皂苷活性更强的理论提供了直接证据。
此外,多糖组分虽与ABTS阳离子自由基清除率(P<0.001)及α-葡萄糖苷酶抑制率(P<0.001)呈高度显著正相关,但其在肠道阶段的黏度效应可能与超氧阴离子自由基清除率的负相关(r=-0.39)存在潜在关联。这一现象提示多糖可能通过物理屏障作用影响部分抗氧化途径,其具体机制有待后续研究验证。
结论
乳酸菌发酵显著提升了人参在体外模拟消化过程中活性物质的释放及功能活性。结果表明,发酵预处理通过降解细胞壁促进结合态总酚和总黄酮的释放,其中总酚在肠消化阶段达到最大值(3.65±0.11)mg/g,较未发酵组提高30.3%。总黄酮释放量在肠消化后期恢复至(1.18±0.04)mg/g,但胃酸环境导致其含量短暂下降。发酵组在肠消化阶段的多糖释放量高于未发酵组,表明发酵虽消耗部分多糖,但提高了其肠道生物可及性。
通过HPLC分析发现,乳酸菌发酵促使原型人参皂苷(如Rb1、Re、Rg1)显著减少,稀有人参皂苷(如F2、Rg3、CK、Rh2)含量显著增加。未发酵组在肠消化阶段的稀有人参皂苷F2、Rg3、CK释放量最高分别达到(10.21±0.19)、(0.62±0.13)mg/g和(1.59±0.08)mg/g,而发酵组F 2、Rg3和C K释放量最高则分别达到了(12.57±0.07)、(8.32±0.54)mg/g和(7.25±0.21)mg/g,相较于未发酵组进一步提升23.1%、1 241.9%、355.9%。发酵组Rh2释放量在肠消化阶段最高达到(1.81±0.12)mg/g,明显高于未发酵组(0.38±0.07)mg/g。推测Rb1经胃酸水解生成Rd,进一步在肠道酶作用下转化为Rg3、F2、CK;Rg3、F2脱糖基生成Rh2,表明发酵与消化协同促进皂苷的生物转化。
功能活性分析显示,发酵组的抗氧化能力(ABTS阳离子自由基清除率(89.22±3.04)%、铁离子还原能力0.57±0.01、超氧阴离子自由基清除率(41.36±0.96)%)及α-葡萄糖苷酶抑制活性((83.81±0.71)%)均显著高于未发酵组。相关性分析表明,稀有人参皂苷(F2、Rg3、CK、Rh2)与抗氧化活性(ABTS阳离子自由基清除率、铁离子还原能力)、降血糖活性呈极显著正相关(P<0.01),而原型人参皂苷(Rg1、Re)与抗氧化活性、降血糖活性呈负相关,验证了稀有人参皂苷比原型人参皂苷活性更强的理论。
本研究在简化发酵基质(仅人参粉和水)条件下,通过方法创新与机制解析,实现了与同类研究的差异化突破。本研究区别于营养强化基质优化人参发酵工艺,通过简化发酵基质排除外源碳氮干扰,系统揭示了“发酵预处理”与“消化环境”的协同增效机制,证实了简化基质下发酵-消化协同仍可高效激活人参活性成分。进一步发现,未发酵组中Rb1等原型人参皂苷在胃消化阶段的“先降后升”现象源于低pH值诱导的疏水聚集沉淀及肠液复溶机制,而发酵组通过预处理消除该波动,显著提升消化稳定性。上述结论填补了“发酵-消化”协同提升人参功能活性的研究空白,为开发高生物利用度人参功能性食品提供了理论支撑。未来需结合体内模型进一步验证发酵-消化协同作用对活性成分代谢途径的影响。
作者简介

谢纯良,中国农业科学院麻类研究所生物加工研究室副主任,研究员,博士生导师,中国农业科学院科技创新工程南方特色农产品生物加工团队首席科学家,中国农业科学院优秀青年英才、湖南省湖湘青年英才和长沙市杰出创新青年。主要从事农产品生物发酵化妆品和功能食品原料技术研发工作。先后主持国家自然科学基金项目、国家博士后面上基金、中国农业科学院基本业务费等项目多项;第二完成人获得湖南省技术发明二等奖1 项;取得授权国家发明专利近40 项(第一发明人的13 项);在国内外期刊发表论文30余篇,其中SCI 收录论文20多篇。

郑志豪,中国农业科学院麻类研究所硕士研究生,研究方向为农产品资源利用,参与省部级项目1项。
引文格式:
郑志豪, 李晓春, 林登蕃, 等. 植物乳植杆菌发酵对人参体外模拟消化中活性物质含量及功能活性的影响[J]. 食品科学, 2025, 46(22): 236-245. DOI:10.7506/spkx1002-6630-20250603-015.
ZHENG Zhihao, LI Xiaochun, LIN Dengfan, et al. Effect of Lactiplantibacillus plantarum fermentation on the contents and functional activities of active substances in ginseng during in vitro simulated digestion[J]. Food Science, 2025, 46(22): 236-245. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-20250603-015.
点击下方阅读原文即可查看文章相关信息。
实习编辑:魏雨诺;责任编辑:张睿梅。点击下方阅读原文即可查看全文。图片来源于文章原文及摄图网
近期研究热点



长按或微信扫码进行注册
会议招商招展
联系人:杨红;电话:010-83152138;手机:13522179918(微信同号)


