Grass Res 编委动态 | 南京农业大学郭振飞教授团队揭示草地早熟禾PpZAT12功能及其在耐旱性中的分子机制
- 2026-02-07 03:31:16

2025年12月,BMC Plant Biology在线发表了南京农业大学郭振飞教授团队题为PpZAT12 from a native Kentucky bluegrass (Poa pratensis L.) confers drought tolerance through regulating antioxidant defense system and multiple metabolic pathways的研究论文。
研究背景
干旱是影响全球植物生长和作物产量的主要非生物胁迫,因此解析植物耐旱的分子机制对于培育抗逆新品种至关重要。植物通过复杂的转录重编程来适应干旱,其中转录因子家族扮演核心角色。草地早熟禾(Poa pratensis L.)是一种应用广泛的优质冷季型草坪草和牧草,它虽耐寒,但对干旱胁迫较为敏感。本文的研究对象是来源于一个原生于青藏高原高寒地区、具有优异抗逆性的草地早熟禾‘青海’品种中的一个干旱响应基因PpZAT12。
学术界已证实C2H2型锌指蛋白(ZFPs)是调控植物非生物胁迫响应的关键转录因子。大量研究揭示了不同物种中ZFP家族成员的功能,例如,ZAT10、OsZFP245、ZAT6 和TaZFP1B 等基因被证明可通过激素信号、渗透调节和抗氧化等途径正向调控植物的耐旱耐盐性。这些研究主要集中在水稻、拟南芥、小麦等模式植物和主要作物上。然而,尽管ZFP家族功能的重要性已广为人知,但它们在草地早熟禾这类重要的草坪草和牧草物种中的具体功能,尤其是在响应干旱胁迫方面的作用,仍然是一个研究空白,相关分子机制尚不明确。
当前面临的挑战是如何将已在模式植物中建立的耐旱分子机制知识,应用于改良草地早熟禾等重要经济草种的抗逆性。虽然已有研究从生理生化及转录组层面初步探索了草地早熟禾的干旱响应,但对具体功能基因的解析仍然非常有限。本研究团队前期的转录组分析发现,PpZAT12基因在干旱胁迫下显著上调,暗示其可能扮演重要角色。因此,本研究的意义在于首次克隆并验证草地早熟禾中的PpZAT12基因功能,旨在填补该领域的研究空白。通过阐明其在调节抗氧化系统和代谢途径以增强耐旱性中的具体作用,不仅能深化对草坪草抗逆分子机理的理解,也为未来通过基因工程手段改良草地早熟禾及其他相关草种的耐旱性提供了宝贵的候选基因和理论依据。
研究方法
2.1实验材料处理与核心基因分析
本研究选用源自青藏高原的草地早熟禾‘青海’品种和水稻‘中华11’作为实验材料。通过在营养液中添加PEG-6000模拟渗透胁迫,以探究植物的干旱响应。实验的关键步骤始于从胁迫处理后的草地早熟禾组织中提取总RNA,随后通过反转录获得cDNA,并利用PCR技术成功克隆了目标基因PpZAT12的编码序列。为量化其表达动态,采用实时荧光定量PCR(qRT-PCR)技术,以PpActin为内参,分析了PpZAT12在不同组织及胁迫条件下的相对表达水平。
2.2 基因功能的功能性验证体系
为揭示PpZAT12基因的生物学功能,构建了一套完整的功能验证体系。首先,通过构建PpZAT12-GFP融合蛋白表达载体,并将其与核定位标记共转染水稻原生质体,利用荧光显微镜观察确定了PpZAT12蛋白在细胞核内的亚细胞定位。其次,构建了由Ubi启动子驱动的 PpZAT12 过表达载体,通过农杆菌介导法将其导入水稻,经过严格的抗性筛选获得了稳定遗传的纯合转基因株系。这一转基因体系的建立,为后续深入研究PpZAT12在整体植株水平上的功能奠定了基础。
2.3 转基因植株的综合表型与多组学分析
为系统评估PpZAT12 过表达对水稻耐旱性的影响,对转基因植株进行了一系列综合性分析。在生理层面,通过测定胁迫处理后植株的相对含水量(RWC)、细胞膜离子外渗率、抗氧化酶(SOD, CAT, APX)活性及脯氨酸含量,评估其生理耐受性。在代谢层面,采用高效液相色谱(HPLC-RID)技术定量分析了植株体内多种可溶性糖含量的变化。在分子层面,利用高通量RNA测序(Transcriptomic analysis)技术,全面比较了转基因与野生型植株在胁迫条件下的基因表达谱差异,并通过生物信息学方法对差异表达基因进行功能富集分析。所有数据均经过方差分析和Duncan检验(p < 0.05)进行统计学评估,以确保结论的可靠性。

研究结果
基因筛选:基于RNA-seq数据,筛选出37个渗透胁迫响应的候选ZFP基因,其中PpZAT12 因在叶片和根中均显著上调而被选中。
序列特征:PpZAT12基因开放阅读框(ORF)为546 bp,编码181个氨基酸,构建的系统发育树显示其与水稻 OsZAT12 亲缘关系最近。
细胞定位:PpZAT12-GFP融合蛋白与核定位标记共表达,荧光信号仅在细胞核中观察到,表明其为核蛋白。
组织表达:qRT-PCR分析显示,PpZAT12 在根、茎、叶和穗中均有表达,其中根部表达水平最高。
胁迫诱导:渗透胁迫处理后,PpZAT12 转录本在6小时内被诱导,并持续高水平表达至48小时。
基于草地早熟禾在渗透胁迫下的RNA-seq数据,通过严格阈值筛选鉴定了37个候选锌指蛋白(ZFP)基因。其中,PpZAT12因其在叶片和根中均表现出显著且同步的上调表达而被选为后续研究对象,并通过RT-qPCR验证了其表达模式。序列分析表明,PpZAT12基因包含一个546 bp的开放阅读框(ORF),编码一个由181个氨基酸组成的肽段,其分子量为43.30 kDa。系统发育分析显示,PpZAT12与水稻的OsZAT12 亲缘关系最近。为确定其亚细胞定位,将PpZAT12-GFP 与核定位标记OsMADS-mCherry 在水稻原生质体中进行共表达,结果显示 PpZAT12-GFP 的荧光信号与核标记重合,证实其定位于细胞核。此外,对不同组织的表达分析发现,PpZAT12 在根中表达水平最高,且其转录本在渗透胁迫后6小时内被快速诱导,并能维持高水平表达至48小时(图1)。
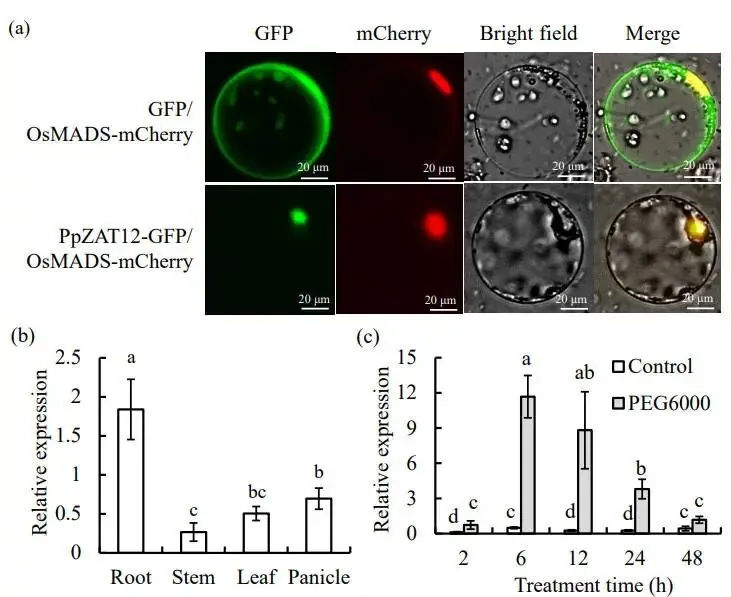
图1 PpZAT12的亚细胞定位、空间表达及对渗透胁迫的响应分析
(a) 将PpZAT12-GFP或GFP载体与mCherry标记的核定位基因OsMADS共转化水稻原生质体,进行亚细胞定位分析。(b) 分别从正常生长条件下的草地早熟禾根、茎、叶和穗中分离总RNA,或(c)从经23% PEG-6000处理后的叶片中分离总RNA,通过qRT-PCR分析其相对表达量。数据为三次独立样本的平均值及标准误;柱上方的相同字母表示在P < 0.05水平下,根据Duncan检验无显著差异
3.2 PpZAT12的转录激活活性
酵母验证:酵母单杂交实验表明,与GAL4 DNA结合域融合的PpZAT12能够激活报告基因的表达。
荧光素酶实验:双荧光素酶报告实验显示,与对照相比,表达GAL4 BD-PpZAT12融合蛋白的原生质体中LUC/REN相对比值显著增加。
为探究PpZAT12蛋白是否具有转录调控功能,进行了转录激活活性分析。在酵母系统中的自身反式激活实验显示,与GAL4 DNA结合域(BD)融合的PpZAT12蛋白能够激活报告基因的表达,使酵母在缺陷型培养基上生长。进一步通过双荧光素酶报告实验在植物细胞中进行验证,结果表明,与空载体对照组相比,表达GAL4 BD-PpZAT12效应子的原生质体中,荧光素酶(LUC)与海肾荧光素酶(REN)的相对表达比值显著升高。这些结果共同表明,PpZAT12具有转录激活活性(图2)。
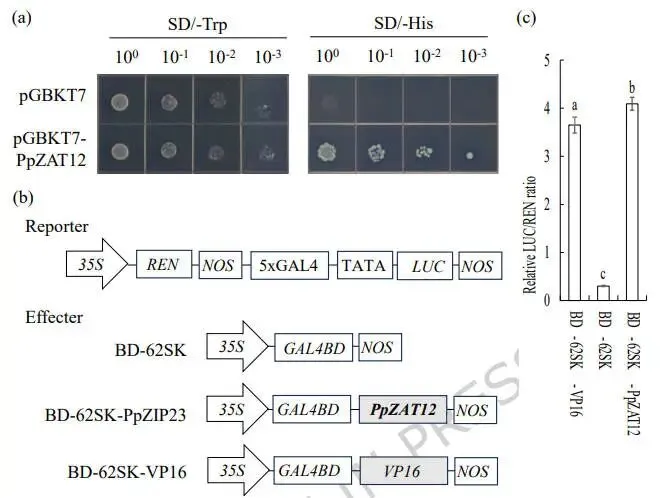
图2 PpZAT12蛋白的转录激活活性分析
(a) 在酵母细胞中检测PpbZIP23的转录激活活性,以空载体(pGBKT7)为阴性对照。(b) 利用效应子和报告载体,(c)通过双荧光素酶报告实验观察荧光并定量相对荧光素酶强度。数据为五次重复的平均值及标准误;柱上方的相同字母表示在P < 0.05水平下,根据Duncan检验无显著差异
3.3 过表达PpZAT12增强水稻的渗透胁迫耐受性与抗氧化防御
获得转基因株:成功构建了过表达PpZAT12的转基因水稻,并筛选出纯合株系(OE3, OE15)用于后续实验。
胁迫表型:渗透胁迫5天后,转基因株系比野生型(WT)表现出更轻微的萎蔫,且复水后恢复能力更强。
生理指标:胁迫后,转基因株系维持了比WT更高的相对含水量(RWC)和更低的离子外渗率。
抗氧化酶活性:胁迫条件下,转基因株系中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性均显著高于WT。
脯氨酸积累:胁迫后,转基因株系积累了显著高于WT水平的脯氨酸。
为了评估PpZAT12在植物耐旱性中的作用,构建了过表达该基因的转基因水稻。筛选出两个稳定遗传的纯合株系(E3和OE15)进行渗透胁迫处理。表型观察显示,经过5天的胁迫处理,野生型(WT)植株表现出比过表达株系更严重的萎蔫,且复水7天后的恢复情况也较差。生理指标测定结果表明,胁迫后,过表达株系的相对含水量(RWC)显著高于WT,而反映细胞膜损伤程度的离子外渗率则显著低于WT (图3)。此外,对主要的抗氧化酶系统和渗透调节物质的分析发现,在胁迫条件下,SOD、CAT和APX的活性以及脯氨酸的含量在所有植株中均有增加,但这些指标在两个过表达株系中的水平均显著高于WT (图4)。这些结果表明,过表达PpZAT12能够通过增强抗氧化防御系统来提升水稻的渗透胁迫耐受性。
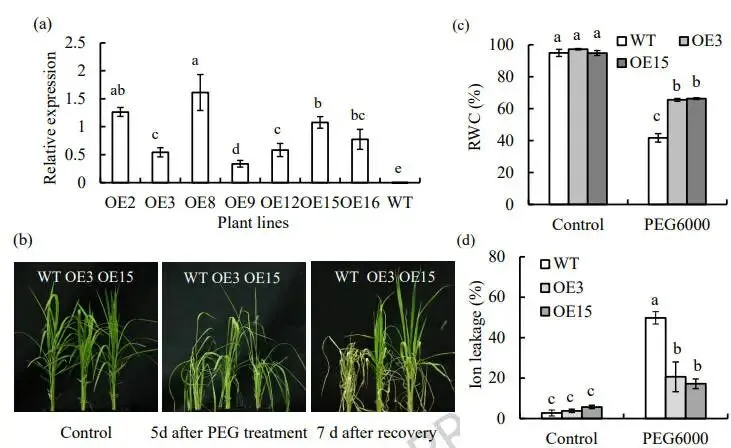
图3 过表达PpZAT12增强水稻的渗透胁迫耐受性
(a) 用于胁迫处理的野生型(WT)及两个过表达株系(OE3, OE15)的表型。(b) 植株在正常条件、PEG处理5天后以及复水7天后的表型比较。(c) 胁迫处理后植株的相对含水量(RWC)和(d)离子外渗率。数据为平均值及标准误;柱上方的相同字母表示在P < 0.05水平下,根据Duncan检验无显著差异
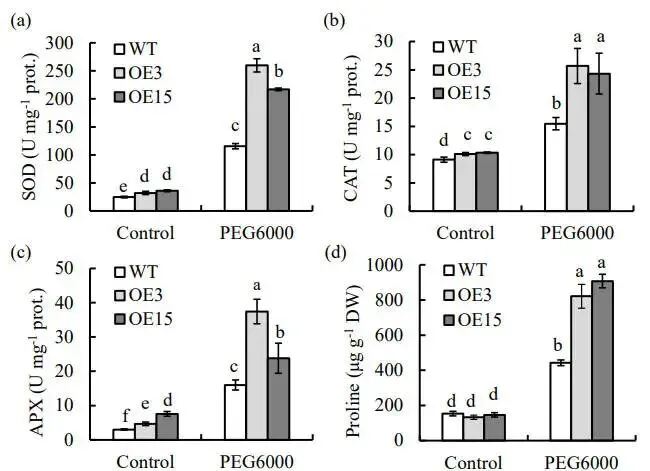
图4 过表达PpZAT12对水稻抗氧化酶活性及脯氨酸含量的影响
(a) 超氧化物歧化酶(SOD),(b) 过氧化氢酶(CAT),(c) 抗坏血酸过氧化物酶(APX)的活性,以及(d)脯氨酸含量。数据为平均值及标准误;柱上方的相同字母表示在P < 0.05水平下,根据Duncan检验无显著差异
3.4 PpZAT12调控的渗透胁迫响应基因的转录组分析
差异基因鉴定:在WT和OE株系中分别鉴定出受渗透胁迫调控的差异表达基因(DEGs),并通过Venn图分析确定了OE株系中特有的588个上调和395个下调基因。
KEGG富集分析:对OE株系特有的上调DEGs进行KEGG富集分析,发现其显著富集于果糖和甘露糖代谢、氨基酸代谢、淀粉和蔗糖代谢等13条通路。下调DEGs则显著富集于半乳糖代谢、氨基酸生物合成等7条通路。
为探究PpZAT12调控耐旱性的分子机制,对一个过表达株系(OE)和野生型(WT)在渗透胁迫下的转录组进行了比较分析。结果在WT和OE株系中分别鉴定出数千个响应渗透胁迫的差异表达基因(DEGs)(图S3a, b)。通过Venn图比较,发现在OE株系中存在588个特异性上调和395个特异性下调的基因,这些基因可能是受PpZAT12直接或间接调控的下游靶基因(图S3c, d)。对这些特异性DEGs进行KEGG通路富集分析,结果显示,上调的基因显著富集于包括果糖和甘露糖代谢、甘氨酸、丝氨酸和苏氨酸代谢、淀粉和蔗糖代谢、糖酵解/糖异生以及氨基酸生物合成在内的13条代谢通路(图S4)。而下调的基因则显著富集于半乳糖代谢、缬氨酸、亮氨酸和异亮氨酸生物合成以及苯丙烷类生物合成等7条通路(图S5)。
3.5 PpZAT12调控淀粉和糖代谢相关基因的表达
淀粉代谢:OsGBSSⅡ、OsBAM1和OsPho1等基因在OE株系中上调,表明淀粉的合成与降解均得到加强。
糖酵解途径:参与糖酵解的多个关键酶基因,如OsPFP、OsFBA5、OsTPI等,在OE株系中表达上调,暗示糖酵解过程被激活。
海藻糖合成:OsTPS8基因在OE株系中上调,预示着海藻糖的生物合成可能被PpZAT12调控。
甘露糖合成:参与D-甘露聚糖降解以产生甘露糖的OsMAN1和OsMAN2基因在OE株系中上调。
RT-qPCR验证:对9个相关基因的RT-qPCR分析结果与转录组数据高度一致,证实了PpZAT12对这些基因表达的调控作用。
转录组分析揭示了PpZAT12对参与淀粉和糖代谢的多个基因具有调控作用。具体而言,参与淀粉合成(OsGBSSⅡ)和降解(OsBAM1, OsPho1)以及葡萄糖生成(OsBGL1/24/28)的基因均在过表达株系中上调。同时,参与海藻糖合成的关键基因OsTPS8、参与糖酵解途径的多个基因(OsPFP1α1, OsPFP14, OsFBA5等)以及参与甘露糖生成的基因(OsMAN1, OsMAN2)也均被上调,而参与半乳糖代谢的基因(OsAGA2, OsGALM)则被下调 (图5)。为了验证转录组数据的可靠性,通过RT-qPCR对9个选定的基因进行了表达分析。结果显示,这些基因的表达模式与转录组分析结果基本一致,例如OsGBSSII、OsBAM1、OsBGL1 和OsTPS8 等基因在胁迫下的诱导表达水平在OE株系中显著高于WT,证实了PpZAT12对淀粉和糖代谢途径的广泛调控作用 (图6)。
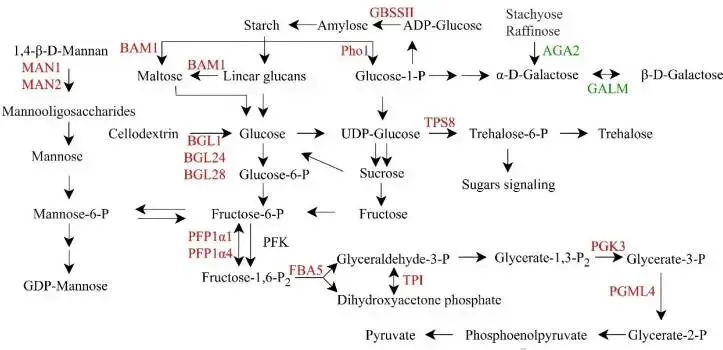
图5 PpZAT12调控的淀粉和糖代谢通路示意图
图中总结了16个上调基因和2个下调基因所编码的酶及其参与的代谢途径
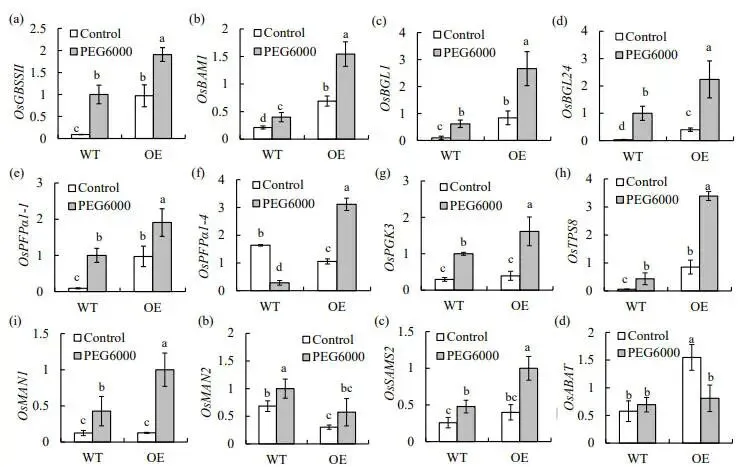
图6 渗透胁迫下WT和PpZAT12过表达株系中部分基因的相对表达水平
(a-j) 淀粉和糖代谢相关基因。(k, l) 氨基酸代谢相关基因。数据为平均值及标准误;柱上方的相同字母表示在P < 0.05水平下,根据Duncan检验无显著差异
3.6 过表达PpZAT12影响糖类积累
糖含量测定:通过HPLC-RID测定了胁迫前后WT和OE株系中多种可溶性糖的含量。
主要糖分变化:胁迫后,OE株系中的葡萄糖、果糖、海藻糖和甘露糖含量均显著高于WT,而蔗糖含量则低于WT。
为探究PpZAT12 调控基因表达对代谢产物的影响,测定了植株在胁迫前后的可溶性糖含量。结果显示,渗透胁迫导致所有植株中的蔗糖、葡萄糖、果糖、海藻糖和棉子糖族寡糖(stachyose)含量增加。与WT相比,OE株系在胁迫条件下积累了显著更高水平的葡萄糖(高53-60%)、果糖(高11-21%)、海藻糖(高44-59%)和甘露糖(高41-60倍)。值得注意的是,OE株系中的蔗糖含量在胁迫下反而低于WT。而棉子糖族寡糖和半乳糖的含量在WT和OE株系间无显著差异。这些结果表明,过表达PpZAT12通过重塑糖代谢网络,显著促进了多种保护性糖类(如葡萄糖、海藻糖和甘露糖)的积累(图7)。
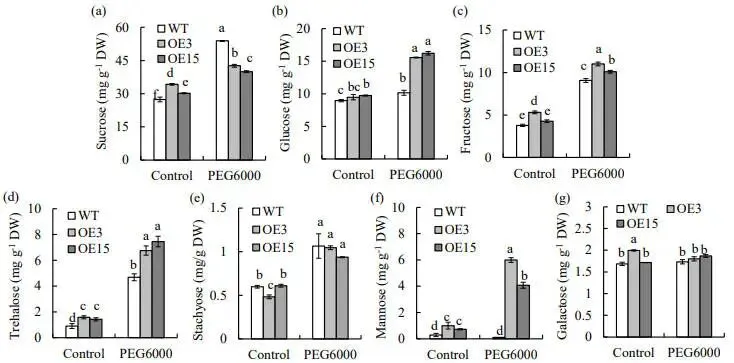
图7 渗透胁迫下WT和PpZAT12过表达株系中糖含量的变化
(a) 蔗糖, (b) 葡萄糖, (c) 果糖, (d) 海藻糖, (e) 棉子糖族寡糖, (f) 甘露糖, (g) 半乳糖。数据为平均值及标准误;柱上方的相同字母表示在P < 0.05水平下,根据Duncan检验无显著差异
3.7 PpZAT12调控氨基酸生物合成与代谢相关基因的表达
氨基酸通路:多个参与甘氨酸、丝氨酸、苏氨酸代谢和赖氨酸生物合成的基因在OE株系中上调,而参与天冬酰胺合成和GABA分解的基因则下调。
关键基因验证:RT-qPCR证实,参与多胺合成前体(SAM)合成的OsSAMS2基因在OE株系中表达更高,而参与GABA分解的OsABAT基因的诱导表达则受到抑制。
代谢物积累:基因表达的改变预示着PpZAT12可能通过促进多胺和GABA的积累来增强植物的耐旱性。
转录组分析同样揭示了PpZAT12对氨基酸生物合成与代谢途径的调控。在过表达株系中,多个参与天冬氨酸家族氨基酸(如赖氨酸、苏氨酸、蛋氨酸)合成的基因(AK, AK-HSDH2)以及S-腺苷甲硫氨酸合成酶基因(SAMS2)被上调,而天冬酰胺合成酶基因(ASNS1)和γ-氨基丁酸转氨酶基因(ABAT)则被下调 (图8)。RT-qPCR验证了OsSAMS2在OE株系中的表达水平更高,而OsABAT在胁迫下的诱导表达则在OE株系中受到抑制(Fig. 6k, l)。S-腺苷甲硫氨酸是多胺合成的前体,而ABAT的下调则有利于γ-氨基丁酸(GABA)的积累。这些结果共同表明,PpZAT12通过调节氨基酸代谢通路,可能促进了多胺和GABA这两种重要的胁迫响应物质在植物体内的积累,从而增强耐旱性。
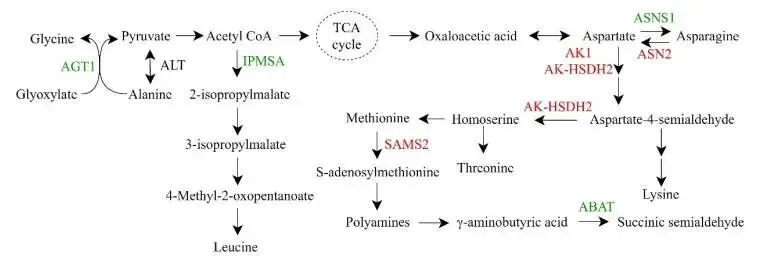
图8 PpZAT12调控的氨基酸生物合成与代谢通路示意图
图中总结了相关上调和下调基因及其在代谢网络中的位置
研究创新性
拓展了研究物种与材料的范畴:以往关于ZFP转录因子功能的研究多集中于水稻、拟南芥等模式植物或大田作物。本研究首次将目光投向了草地早熟禾(Poa pratensis L.)这一重要的冷季型草坪草与牧草。更具创新性的是,研究材料来源于一个从青藏高原海拔4000米高寒地区驯化而来的、具有极强抗逆性的‘青海’本地品种,这使得研究结论对于理解植物在极端环境下的适应性进化具有独特的价值,并将基础研究的成果与改良重要经济草种的实际需求紧密联系起来。
首次克隆并鉴定了草地早熟禾中的关键耐旱基因PpZAT12:论文明确指出,尽管ZFP家族功能多样,但其在牧草和草坪草中的功能,特别是与耐旱性相关的基因功能,在很大程度上是未知的。本研究成功地从草地早熟禾中分离并克隆了PpZAT12基因,并通过在水稻中进行异源过表达实验,首次证实了该基因是草地早熟禾响应干旱胁迫、并正向调控植物耐旱性的一个关键功能基因。这一发现填补了该研究领域的空白。
系统性地揭示了PpZAT12调控耐旱性的多路径分子机制:本研究的创新性不仅在于发现了一个新基因,更在于通过转录组学和代谢组学的联合分析,深入且系统地揭示了其复杂的调控网络,超越了以往研究中仅关注少数下游标记基因的局限。
揭示了对糖代谢的精细重塑:研究发现PpZAT12不仅上调了淀粉合成与降解,促进了葡萄糖和果糖的积累,更关键的是,它显著上调了海藻糖合成关键基因(OsTPS8)和甘露糖合成相关基因(OsMAN1, OsMAN2)的表达,最终导致了保护性糖类——海藻糖和甘露糖在胁迫下的大量积累。特别是甘露糖含量高达40-60倍的剧增,是PpZAT12调控功能的一个非常突出且新颖的发现。
阐明了对氨基酸代谢的双重调控:研究创新性地发现PpZAT12通过“开源节流”的方式调控两种重要的胁迫响应氨基酸。一方面,它通过上调OsSAMS2的表达来促进多胺和乙烯的共同合成前体—S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)的生成(开源);另一方面,它抑制了GABA分解关键酶基因(OsABAT)在胁迫下的表达(节流),从而协同促进了多胺和GABA的积累。这种对代谢通路上下游关键节点的协同调控机制,为理解ZFP蛋白的精细调控功能提供了新的视角。
Grass Res | 四川农业大学张新全团队建立多年生黑麦草热激转录因子家族响应多重逆境胁迫表达图谱
Grass Res | 兰州大学张吉宇教授团队在紫花苜蓿基因组选择育种研究方面取得新进展
关于Grass Research
Grass Research 是一本开放获取,仅在线出版的英文学术期刊,于2021年1月正式创刊。期刊致力于发表关于草类植物科学和相关领域的研究论文、综述、方法和观点性文章。期刊聚焦在自然生态系统或栽培系统中草类植物的生物机理研究以及其与环境和微生物的相互作用,如饲草(包括豆科植物)、草坪草、观赏草、生物能源草;或者可用于提高草类生产力和对生物或非生物胁迫适应性的其他植物,所提供的相关研究信息和方法。本刊由Maximum Academic Press出版,期刊主编由美国罗格斯大学黄炳茹教授担任。目前已被ESCI、Scopus、CABI等数据库收录。科睿唯安JCR2024影响因子:2.2。
期刊官网:
www.maxapress.com/grares

投稿链接:
mc03.manuscriptcentral.com/grares


关注草学研究
草学研究公众号专注于草类植物研究领域的最新前沿进展,点击下方名片关注草学研究!

点击“阅读原文”,查看文章原文
