中国农业大学张永亮团队Trends in Biochemical Sciences综述 | 翻译后修饰精细调控NLR蛋白介导的植物免疫
- 2026-02-09 23:37:54


生命科学
Life science


植物胞内免疫受体NLR (nucleotide-binding leucine-rich repeat receptor) 蛋白在识别病原物编码的效应因子过程中发挥核心作用,其激活依赖复杂的构象变化、组装以及信号输出。随着近年来多个抗病小体 (resistosome) 结构被解析,人们对NLR激活机制的理解不断深化。然而,NLR如何在细胞环境中被精细调控以避免免疫异常激活及生长代价,仍是植物免疫领域的重要科学问题。
近日,中国农业大学张永亮教授团队在Cell Press细胞出版社旗下期刊Trends in Biochemical Sciences发表了题为“Regulation of plant NLRs by post-translational modifications”的综述。该文系统总结了近年来翻译后修饰 (post-translational modifications, PTMs) 在调控植物NLR免疫受体中的重要作用,为通过NLR工程化改造来提升作物抗病性提供了重要参考。


有兴趣在Trends in Biochemical Sciences发表您的综述文章?请扫描提交论文提案 (presubmission inquiry)。
NLR蛋白结构多样性及翻译后修饰调控概述
动物和植物中NLR在先天免疫中都发挥核心作用。在动物细胞中,NLR蛋白通过组装炎症小体(inflammasomes)来介导先天免疫反应,从而诱导细胞焦亡。类似地,在植物中,NLR受体激活会发生构象变化并寡聚化为“抗病小体”。例如,ZAR1寡聚化形成五聚体并定位至细胞膜形成钙离子通道,TNLs则形成具有NADase活性的四聚体,从而启动强烈的免疫反应,限制病原体扩散。然而,植物NLR蛋白从静息状态向激活状态转变,是一受到严格控制的动态过程,涉及构象变化、亚细胞定位、寡聚化、蛋白稳定性调控,以及与下游信号蛋白的复杂相互作用。越来越多的证据表明,NLR蛋白的激活须被精细调控。异常或过度激活免疫会导致自身能力损耗、生长受阻甚至细胞死亡(自身免疫);而激活强度不够则无法限制病原物的侵染。磷酸化、泛素化、脂化、乙酰化、SUMO化等PTMs正是作为分子“开关”来实现对NLR功能的精细调控。
1、植物NLR蛋白的磷酸化修饰
虽然动物中的炎症小体(尤其是NLRP3)在磷酸化调控方面已得到深入研究,但植物中抗病小体的磷酸化调控仍报道较少。最新研究显示,CNL和TNL类型的植物NLR可直接作为激酶底物,从而通过磷酸化改变其构象、寡聚化能力和下游信号活性(见图一)。例如,单子叶植物中首个鉴定的抗病毒CC-NB-LRR类型BSR1蛋白会被WAKL20激酶磷酸化,该修饰会导致NBD和WHD功能域互作界面的空间位阻(steric clashes)进而影响BSR1蛋白的寡聚化及后续的激活。类似地,TNL蛋白SNC1被钙依赖蛋白激酶CPK3磷酸化,其NADase活性受到显著抑制,从而防止过度免疫造成的生长损伤,该调控机制在植物与动物TIR蛋白中均具进化保守性。此外,成对型(paired NLR)TNL RRS1-R/RPS4的多位点磷酸化决定其对细菌效应子PopP2与AvrRps4的不同识别模式,调控复合体构象变化及免疫激活过程。综合这些研究,磷酸化在调节NLR构象、酶活性和受体互作中发挥关键作用,并且与泛素化等其他翻译后修饰存在潜在的交互作用 (cross-talk),如通过磷酸降解子 (phosphodegron) 连接激酶活性与蛋白降解路径。总体而言,磷酸化作为控制NLR激活强度与进程的“分子开关”,不仅确保免疫反应的精准性,还防止免疫过度激活与生长抑制的发生。
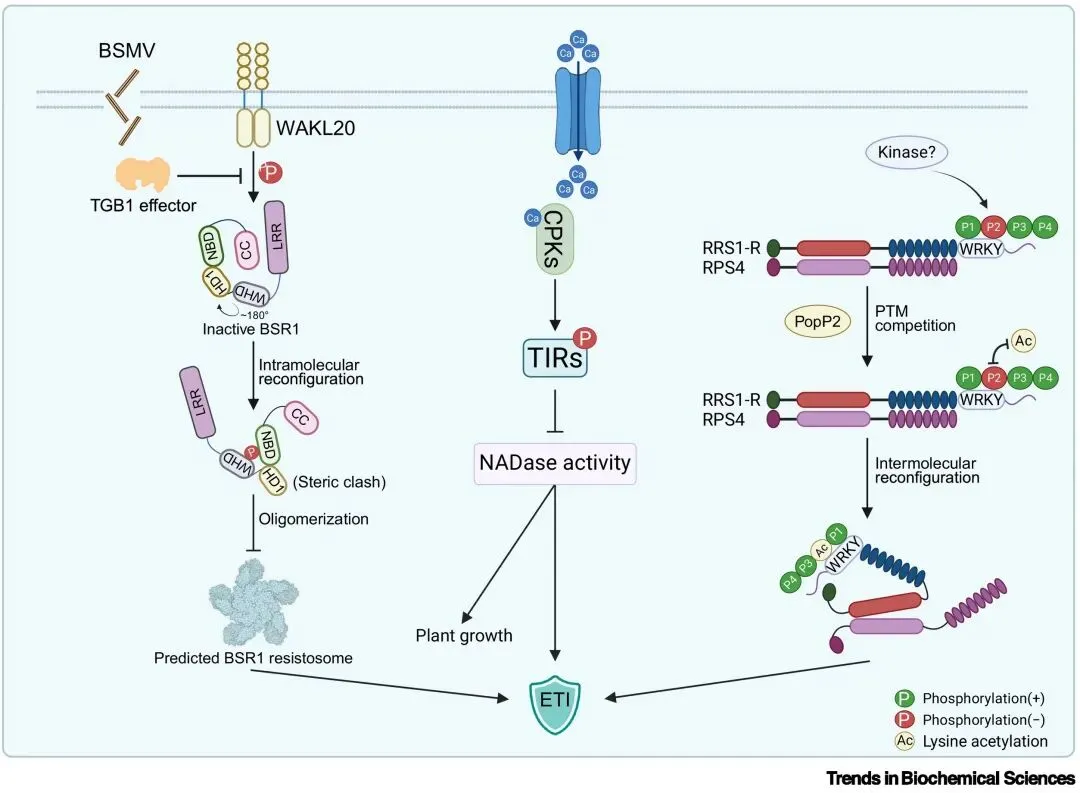
图1. 磷酸化修饰介导的植物NLR免疫受体调控机制
2、植物NLR蛋白的泛素化修饰
植物免疫受体NLR的异常激活会导致生长抑制,因此,通过泛素化精细调控NLR的丰度与活性,是维持生长—防御平衡的关键机制(见图二)。多种E3泛素连接酶通过识别并降解感受型NLR(sNLR),如MIR1、BOI、SBP1、APIP10等,抑制其在非胁迫条件下的自发激活;TNL受体SNC1则由MUSE13/14和SCF
CPR1等复合体严格控制,而SNIPER1/2能广泛靶向多个sNLR维持免疫稳态。E3连接酶还可作用于PRR–NLR交叉节点,如PUB5和PUB44,通过调控CRCK3间接影响NLR激活阈值。对paired NLR,泛素化与去泛素化共同调节其稳定性,例如RARE与UBP12/13协同调控RRS1/RPS4复合体。此外,作为信号传递核心的辅助型NLR(ADR1、NRG1和NRCs)也受泛素化负向调控,病原体可利用AvrPtoB、RipV2或宿主E3降解这些hNLR以抑制免疫。总之,泛素化在多层级调控sNLR、paired NLR与hNLR稳态中发挥核心作用,同时也是病原体针对免疫系统演化出的重要干扰靶点。
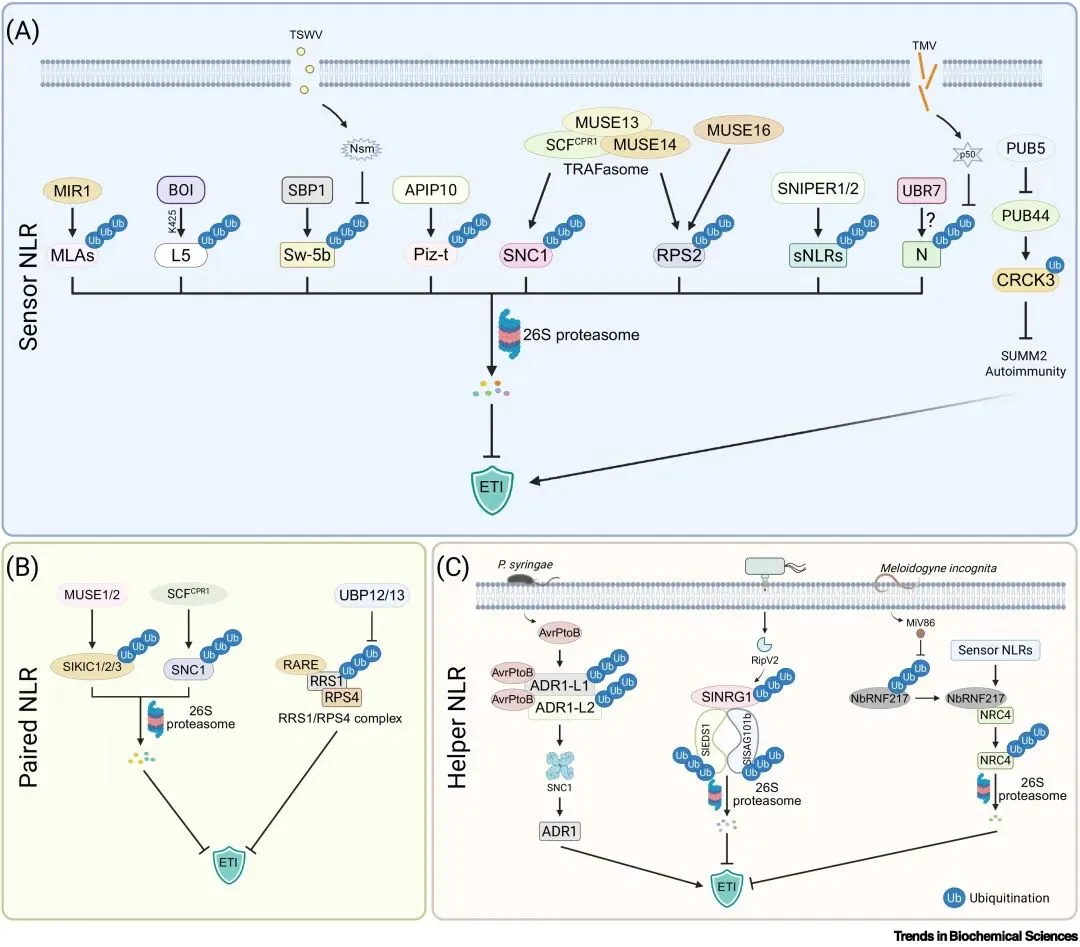
图2. 泛素化修饰介导的植物NLR免疫受体调控机制
3、植物NLR蛋白的脂化修饰
脂化是决定植物NLR受体膜定位与免疫激活的重要机制(见图三)。尽管结构研究表明NLR在激活后会发生寡聚化并与质膜结合,但其膜定位机制长期不明。研究发现,拟南芥的ADR1与RPM1可通过与带负电的磷脂发生静电作用定位于质膜,而直接的翻译后脂化则是一种更高效的膜锚定方式。脂质化包括肉豆蔻酰化和S-酰化(棕榈酰化),可将蛋白锚定于膜上。早在2012年RPS5就被证明需要N端GGC基序的双重脂质化才能稳定定位于膜并正常发挥免疫功能;水稻NLR Pit的N端也依赖棕榈酰化参与膜定位,与OsRac1相互作用并激活对稻瘟病的抗性。大豆NLR Rsc4-3的N端C28/C29脂质化位点对识别大豆花叶病毒CI效应因子至关重要。最新研究进一步鉴定到PAT13和PAT16等多种S-酰基转移酶可催化NLR的N端脂化,如促进R5L1定位于质膜,从而确保其免疫活性。抑制脂化或敲除相关酶均显著削弱抗病性。动物NLRP3亦存在类似调控,且不同半胱氨酸位点的脂质化可产生相反的功能效应。总体而言,脂化是调控植物NLR空间分布与免疫强度的关键PTM,其与其他修饰的交互作用仍是未来研究的重要方向。
4、植物NLR蛋白的乙酰化修饰
乙酰化通过调控NLR的稳定性与降解来维持免疫稳态,从而协调植物生长与防御(见图三)。与主要影响膜定位的脂质化不同,N端乙酰化(NTA)主要决定NLR的命运。在拟南芥中,NLR蛋白SNC1通过不同起始密码子产生多个N端异构体:第一个甲硫氨酸由NatA乙酰化后成为降解信号,而第二个起始位点则由NatB乙酰化以稳定蛋白,体现了位点特异性的拮抗调控。此外,NatA也能促进另一NLR—RPM1的降解。水稻中存在类似机制:OsHYPK促进NatA介导的NTA,限制NLR RPM1-L1的积累以避免异常激活;但在稻瘟病菌感染时,OsHYPK水平下降,使RPM1-L1逃避免疫抑制并触发抗性反应。动物NLRP3的N端亦可被乙酰化,但与植物不同,其乙酰化可促进炎性小体的组装与激活。总体而言,NTA通过改变N端化学性质决定NLR的稳定性,是构建免疫稳态网络、平衡生长与防御的关键机制。
与上述NTA不同,paired NLR(如RRS1-R/RPS4)的乙酰化发生在RRS1-R的C端WRKY区域。青枯雷尔氏菌(Ralstonia solanacearum)效应蛋白PopP2作为乙酰转移酶,可乙酰化WRKY结构域中的关键赖氨酸,从而破坏其与DNA的结合并激活RPS4依赖的免疫。有趣的是,该乙酰化位点(Lys1221)与邻近的磷酸化位点(Thr1214)存在交互作用,表明乙酰化在paired NLR中展现出独特的调控模式。
5、植物NLR蛋白的SUMO化修饰
与其他翻译后修饰相比,关于SUMO化调控植物NLR介导免疫的研究仍十分有限。目前仅有的证据显示,植物NLR蛋白SNC1在体内可被SUMO化(见图三),且SUMO E3连接酶SIZ1的过表达能够部分恢复SNC1过度积累或异常激活所引起的自免疫表型,说明SUMO化对SNC1依赖的免疫具有负调控作用。这与动物中NLRP3被SUMO E3连接酶MAPL修饰后抑制炎性小体活化的现象相似,暗示SUMO化在不同生物界中均可能作为限制NLR激活的保守机制。尽管哺乳动物中介导NLRP3 SUMO化的多种E3酶已被鉴定,但直接SUMO化植物NLR的E3连接酶仍未明确。有趣的是,与乙酰化和脂化中呈现的双重调控模式类似,NLRP3也可被另一SUMO E3酶TRIM28修饰,从而稳定NLRP3并促进炎症小体活化,说明同一种PTM在不同靶点和不同环境下可能具有截然相反的功能。这些发现突显了SUMO化在植物和动物NLR调控中的复杂性,也表明其在免疫动态调控中的作用仍需深入研究。
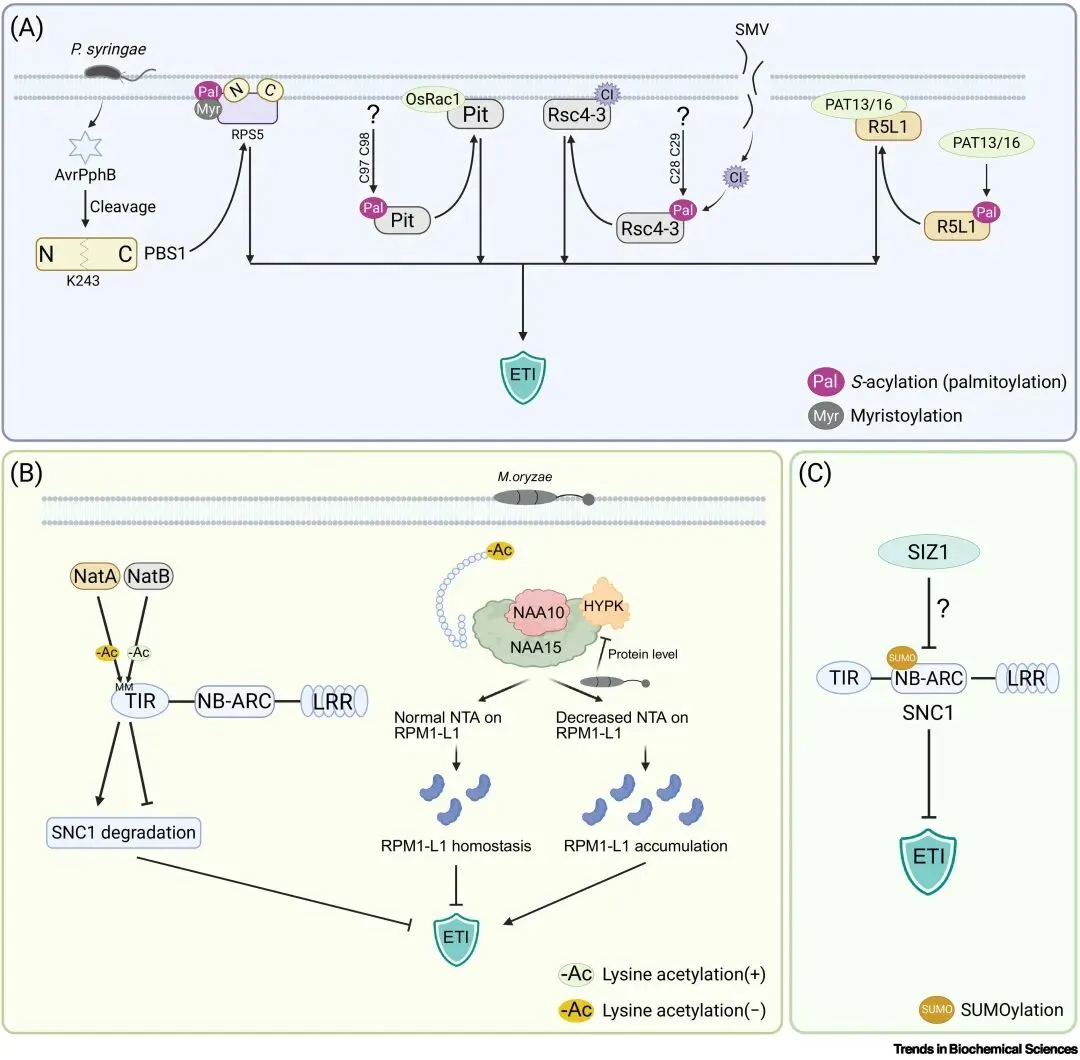
图3. 脂化、乙酰化及SUMO化修饰介导的植物NLR免疫受体调控机制
总结与展望
动物和植物中NLR免疫受体的激活均依赖多种翻译后修饰 (PTMs) 的精细调控,包括磷酸化、泛素化、脂化、乙酰化和SUMO化,这些修饰共同影响NLR的构象、定位、稳定性及信号传递,从而动态调控免疫反应的启动与关闭。相比动物系统中已较为清晰的PTM协同与拮抗机制,植物NLR的PTM机制仍十分有限,尤其是磷酸化调控网络及不同PTM之间的互作关系仍待深入研究。未来阐明PTM的时空动态及其交叉调控,将有助于构建更完整的植物NLR调控模型。这将为作物抗病性遗传改良提供新的切入点。例如,通过定点突变关键PTM位点,可在避免自身免疫的同时保留NLR的活性;调控E3连接酶、激酶或乙酰转移酶的活性,也可精细调控免疫阈值。病原菌常劫持宿主E3连接酶降解NLR,破坏免疫,而改变效应蛋白与NLR或E3的结合界面则可能恢复免疫功能。尽管如此,PTM的环境依赖性、NLR的冗余性及生长–防御平衡的复杂性,使NLR工程化改造仍面临一定挑战。未来需将PTM调控策略与基因编辑、蛋白设计和系统生物学相结合,推动基础研究向作物育种的有效转化。


论文作者介绍


张永亮
教授
张永亮,中国农业大学生物学院植物抗逆高效全国重点实验室教授。主要从事植物病毒致病的分子机制和R基因介导的抗病毒免疫研究。曾获得2021年国家自然科学基金优秀青年科学基金资助(现为国家自然科学基金青年科学基金B类)。以第一和通讯作者(含共同)在Nature Plants、Science Advances、PNAS、Plant Cell和Annual Review of Phytopathology等国内外重要学术刊物上发表系列研究进展,曾入选科睿唯安“全球高被引学者” (2024)。

相关论文信息

相关研究发表在Cell Press细胞出版社
旗下期刊Trends in Biochemical Sciences,
点击“阅读原文”或扫描下方二维码查看论文

▌论文标题:
Regulation of plant NLRs by post-translational modifications
▌论文网址:
https://www.sciencedirect.com/science/article/pii/S096800042500249X
▌DOI:
https://doi.org/10.1016/j.tibs.2025.10.008

▲长按识别二维码阅读论文
推荐阅读



▲长按识别二维码关注细胞科学

